Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+ Mg===Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是( )
A.Mg为电池的正极
B.负极反应为AgCl+e-===Ag+Cl-
C.不能被KCl 溶液激活
D.可用于海上应急照明供电
解析:选D 根据氧化还原判断,Mg为还原剂是负极、失电子,所以A、B都错误,电解质溶液可用KCl 溶液代替,C错误。
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是( )
A.①③②④ B.①③④②
C.③④②① D.③①②④
解析:选B ①②相连时,外电路电流从②流向①,说明①为负极;①③相连时,①为负极;②④相连时,②上有气泡,说明④为负极;③④相连时,③的质量减少,说明③为负极。综上所述可知,这四种金属活动性由大到小的顺序为①③④②,选项B正确。
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
A.HCl、CuCl2、Ba(OH)2
B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2
D.NaBr、H2SO4、Ba(OH)2
解析:选C 电解基本原理考查。电解时只生成氧气和氢气,则电解质所含阳离子在金属活动性顺序表中位于铜之前,阴离子不是简单离子。
工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )
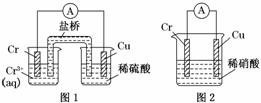
A.图1为原电池装置,Cu电极上产生的是O2
B.图2装置中Cu电极上发生的电极反应式为:Cu-2e-===Cu2+
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电子均由Cr电极流向Cu电极
解析:选B 由图可知装置1和2都是原电池。而在图1装置铜电极上产生大量的无色气泡,说明此时铜电极是正极,溶液中的氢离子放电,即金属Cr的活泼性强于Cu的。而图2装置中铜电极上无气体产生,说明此时铜电极是负极。这是由于电解质发生了变化,Cr在硝酸中不反应,类似于钝化,而铜可以被氧化。所以A、C、D均是错误的。
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是( )
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S===6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
解析:选B 本题考查电化学知识在生活中的应用,意在考查考生运用电化学原理解决实际问题的能力。根据信息可知在银器处理过程中运用了原电池原理,铝质容器作负极,电极反应为2Al-6e-===2Al3+;银器作正极,电极反应为3Ag2S+6e-===6Ag+3S2-;继而Al3+和S2-发生互相促进的水解反应:2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑,故原电池的总反应为:3Ag2S+2Al+6H2O===6Ag+2Al(OH)3+3H2S↑,故C错误。黑色褪去的原因是Ag2S被还原为Ag,此过程中银器质量逐渐减小,故A、D错误,B正确。
本卷还有8题,登录并加入会员即可免费使用哦~

该作品由: 用户江川分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。