木糖醇(C5H12O5)可用作甜味剂、营养剂,在化工、食品、医药等工业中有广泛应用。利用玉米芯中的多糖可以生产木糖醇,其工艺流程如下:
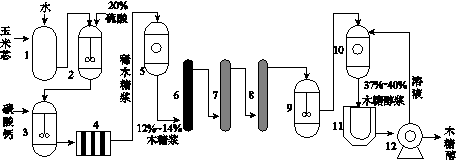
1—浸泡罐;2、3—反应罐;4—板式过滤机;5、10—浓缩罐;
6—脱色柱;12—离心机(固液分离装置)
已知:木糖与木糖醇的转化关系如下:
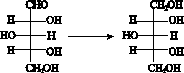
请回答下列问题:
(1)装置2中硫酸的主要作用是________。
(2)装置3中加入碳酸钙的目的是________________________________________________________。
(3)为除去木糖浆中的杂质离子,7、8装置中的填充物依次是__________________________________________。
(4)装置9的作用是________。
A.冷却木糖浆
B.水解木糖
C.氧化木糖
D.还原木糖
(5)装置11的作用是________。
[答案] (1)催化
(2)中和剩余的硫酸,生成产物CaSO4有利于分离
(3)阳离子交换树脂、阴离子交换树脂
(4)D (5)结晶
[解析] (1)玉米水解时需要催化剂,故硫酸用于催化玉米的水解反应。(2)玉米水解完成后,水解液中含有硫酸,加入碳酸钙可将H2SO4转化为微溶的CaSO4,这有利于产品的分离。(3)由流程图知,离子的除去中没有添加其他试剂,故它是利用分离膜进行的分离(除杂)。(4)进入装置9中的是木糖,目标产物是木糖醇,故装置9是用H2还原木糖的装置。(5)由装置12是用于固液分离而进入装置11的是溶液知,装置11是用于结晶的。
工业上用重铬酸钠(Na2Cr2O7)给晶后的母液(含少量杂质Fe3+生产重铬酸钾(K2Cr2O7)。工艺流程及相关物质溶解度曲线如图所示:
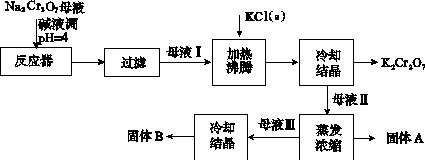
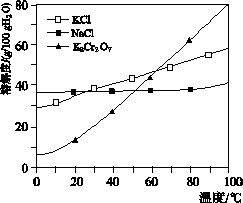
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为____________________________________________。通过冷却结晶析出大量K2Cr2O2的原因是__________________________________________________________。
(2)向Na2Cr2O7母液中加碱液调pH的目的是________________________________________。
(3)固体A主要为________(填化学式)。固体B主要为________(填化学式)。
(4)用热水洗涤固体A,回收的洗涤液转移到母液______(填“Ⅰ”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗最低。
(1)Na2Cr2O7+2KCl===K2Cr2O7+2NaCl 低温下K2Cr2O7溶解度远小于其他组分,随温度的降低,K2Cr2O7溶解度明显减小(合理即可)
(2)除去Fe3+
(3)NaCl K2Cr2O7
(4)Ⅱ
[解析] (1)利用流程图知向母液Ⅰ(溶质为Na2Cr2O7)中加入KCl(s)固体后得到K2Cr2O7,由此可知由Na2Cr2O7生成K2Cr2O7的反应的方程式为Na2Cr2O7+2KCl===K2Cr2O7+2NaCl;再结合溶解度曲线图可知该反应发生的原因是K2Cr2O7的溶解度受温度影响变化大,并且低温时溶解度远比其他组分小,将反应后的热溶液降温可使K2Cr2O7结晶析出。(2)pH=4时,Fe3+可完全转化为Fe(OH)3沉淀,通过过滤可进行固液分离,因此向Na2Cr2O7母液中加碱调节pH=4的目的是除去Fe3+。(3)利用(1)中反应方程式和溶解度曲线知,母液Ⅱ中主要含有NaCl和少量K2Cr2O7,再结合K2Cr2O7在高温时溶解度大可知将母液Ⅱ蒸发浓缩得到固体A应是析出NaCl固体,母液Ⅲ为高温下不饱和的K2Cr2O7溶液,再冷却结晶得到固体B应是K2Cr2O7。(4)洗涤固体A(NaCl)的洗涤液中含有K2Cr2O7,因此将回收液转移到母液Ⅱ中可提高K2Cr2O7的产率,同时降低能耗。
[化学——选修2:化学与技术](15分)
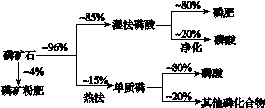
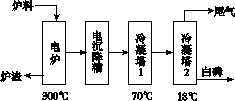
磷矿石主要以磷酸钙[Ca3(PO4)2·H2O]和磷灰石 [Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程。
(a)
(b)
部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,有还原性 |
| SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的________%。
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为________________________________________________________________________。
现有1 t折合含有P2O5约30%的磷灰石,最多可制得85%的商品磷酸________t。
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是________(填化学式),冷凝塔1的主要沉积物是________,冷凝塔2的主要沉积物是________。
(4)尾气中主要含有____________________,还含有少量的PH3、H2S和HF等。将尾气先通入纯碱溶液,可除去____________;再通入次氯酸钠溶液,可除去________。(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是________________________________________________________________________。
(1)69 (2)Ca5F(PO4)3+5H2SO4===3H3PO4+5CaSO4+HF↑ 0.49 (3)CaSiO3 液态白磷 固态白磷 (4)SiF4、CO SiF4、HF、H2S PH3 (5)产品纯度高(浓度大)
[解析] (1)设磷矿石的质量为m,结合图(a)可知转化成磷肥的磷矿石的质量为96%m×85%×80%,转化成矿粉肥的质量为4%m,则用于生产含磷肥料的磷矿石约占磷矿石使用量的69%。(2)湿法磷肥中Ca5F(PO4)3与H2SO4的反应为Ca5F(PO4)3+5H2SO4===3H3PO4+5CaSO4+HF↑。根据P2O5~2H3PO4和0.3 t P2O5可求出制得85%的H3PO4约为0.49 t。(3)图(b)所示工艺中,第一步所得炉渣主要成分为CaSiO3,结合表格中数据信息可确定冷凝塔1和冷凝塔2的主要沉积物分别为液态白磷和固态白磷。(4)尾气中含有SiF4、CO和PH3、H2S、HF等,将其通入纯碱溶液中可除去气体SiF4、H2S和HF,再通入NaClO溶液可除去具有还原性的PH3气体。(5)结合图(a)和图(b)可知图(b)具有产品纯度高的优点。
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
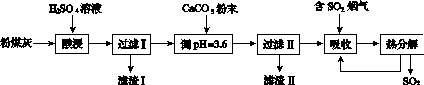
(1)酸浸时反应的化学方程式为____________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是__________________________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是________________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”“减小”或“不变”)。
(1)Al2O3+3H2SO4===Al2(SO4)3+3H2O SiO2
(2)CaSO4 3CaCO3+2Al3++3SO![]() +3H2O===2Al(OH)3+3CaSO4+3CO2↑
+3H2O===2Al(OH)3+3CaSO4+3CO2↑
(3)溶液中的部分SO![]() 被氧化成SO
被氧化成SO![]() 减小
减小
[解析] (1)粉煤灰中的Al2O3能与H2SO4反应生成Al2(SO4)3,而SiO2不能与H2SO4反应,因而滤渣Ⅰ为SiO2。(2)滤液为Al2(SO4)3,与CaCO3反应生成微溶物CaSO4,因而滤渣Ⅱ为CaSO4。溶液中存在Al3++3H2OAl(OH)3+3H+,CaCO3+2H+=== Ca2++H2O+CO2↑,溶液的pH偏高,碱性增强,会促进Al3+水解,铝元素容易转化为Al(OH)3沉淀而导致溶液中铝元素含量降低。(3)+4价S具有较强还原性,溶液中的SO![]() 容易被氧化为SO
容易被氧化为SO![]() 。SO2在水中溶解度较大且SO2溶于水生成H2SO3,且加热时部分H2SO3会被氧化为酸性更强的H2SO4,因而比吸收SO2前酸性增强,pH减小。
。SO2在水中溶解度较大且SO2溶于水生成H2SO3,且加热时部分H2SO3会被氧化为酸性更强的H2SO4,因而比吸收SO2前酸性增强,pH减小。
[化学—化学与技术]工业上用重铬酸钠(Na2Cr2O7)给晶后的母液(含少量杂质Fe3+生产重铬酸钾(K2Cr2O7)。工艺流程及相关物质溶解度曲线如图所示:


(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为____________________________________________。通过冷却结晶析出大量K2Cr2O2的原因是__________________________________________________________。
(2)向Na2Cr2O7母液中加碱液调pH的目的是________________________________________。
(3)固体A主要为________(填化学式)。固体B主要为________(填化学式)。
(4)用热水洗涤固体A,回收的洗涤液转移到母液______(填“Ⅰ”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗最低。
(1)Na2Cr2O7+2KCl===K2Cr2O7+2NaCl 低温下K2Cr2O7溶解度远小于其他组分,随温度的降低,K2Cr2O7溶解度明显减小(合理即可)
(2)除去Fe3+
(3)NaCl K2Cr2O7
(4)Ⅱ
[解析] (1)利用流程图知向母液Ⅰ(溶质为Na2Cr2O7)中加入KCl(s)固体后得到K2Cr2O7,由此可知由Na2Cr2O7生成K2Cr2O7的反应的方程式为Na2Cr2O7+2KCl===K2Cr2O7+2NaCl;再结合溶解度曲线图可知该反应发生的原因是K2Cr2O7的溶解度受温度影响变化大,并且低温时溶解度远比其他组分小,将反应后的热溶液降温可使K2Cr2O7结晶析出。(2)pH=4时,Fe3+可完全转化为Fe(OH)3沉淀,通过过滤可进行固液分离,因此向Na2Cr2O7母液中加碱调节pH=4的目的是除去Fe3+。(3)利用(1)中反应方程式和溶解度曲线知,母液Ⅱ中主要含有NaCl和少量K2Cr2O7,再结合K2Cr2O7在高温时溶解度大可知将母液Ⅱ蒸发浓缩得到固体A应是析出NaCl固体,母液Ⅲ为高温下不饱和的K2Cr2O7溶液,再冷却结晶得到固体B应是K2Cr2O7。(4)洗涤固体A(NaCl)的洗涤液中含有K2Cr2O7,因此将回收液转移到母液Ⅱ中可提高K2Cr2O7的产率,同时降低能耗。
本卷还有44题,登录并加入会员即可免费使用哦~

该作品由: 用户小小分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。