三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1) 铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-,被还原成Mn2+ 。
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
① 配制三草酸合铁酸钾溶液的操作步骤依次是:称量、_______、转移、洗涤并转移、________摇匀。
② 加入锌粉的目的是________。
③ 写出步骤三中发生反应的离子方程式________。
④ 实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量__________。(选填“偏低”“偏高”“不变”)
(2) 结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_____ ____。
【解析】本题主要考察一定物质的量浓度的配制、中和滴定、误差分析、实验操作及有关计算。
【答案】(1)①溶解 定容
②将Fe3+还原成Fe2+
③5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
④11.20%或0.112 偏高
(2)加热后在干燥器中冷却,对盛有样品的坩埚进行多次加热,干燥器中冷却、称量并记录质量,直至称量质量几乎相等。
某钠盐溶液中可能含有![]() 等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中公含![]() 三种阴离子。
三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A. ①②④⑤ B. ③④ C. ③④⑤ D. ②③⑤
【解析】
本题是离子组合推断、离子鉴别实验综合题。题型难点是:熟悉各种离子的标准检验方法,明确各种离子检验时的干扰因素。本题的难点还有:采用的出题方式和平时不同。
根据最终的离子分析:NO2-,存在时一定没有SO32-,I-。因NO2-,的氧化性可以使他们氧化。Cl-存在下的NO2-的检验:加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体。即证明了NO2-的存在又检验出Cl-的存在。但,仅加入盐酸产生刺激性气体也可能有SO32-的存在。故须先确认SO32-不存在。SO32-,CO32-,SO42-的组合检验可以用:加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。来确认SO32-, SO42-不存在,CO32-一定存在。故选择③④就可以,顺序是先④后③。
教与学提示:本题学生存在的困难是NO2-的检验,因为此内容在选修的《实验化学》中,可能会有所忽视。第二个难点是离子要分成两组分别进行检验。教学中碰到有一些学生:只要碰到离子组合检验与推断的题目就死机的现象。分析原因:各种典型离子的检验方式不是很熟练,没有对各种离子单独检验时的干扰因素,干扰离子进行排除。不重视各种相近实验现象进行区别对待,深入研究相近条件下的不同。教学中从单一离子检验开始,增加干扰,增加组合,增加性质区别等逐步复杂化。要多想为什么,多想如何干扰和排除干扰。
【答案】B
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1) 能确定溶液是(写出溶液标号与相应溶质的化学式):
(2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
【解析】(I)由题干表述可知A和E不是盐,又由纯E为无色油状液体,推知E为硫酸(③步操作进一步确定);(II)由题干和①步操作可知A为氨水; (III)再由②步操作可知F中阳离子为Ag+发生的反应为:Ag++NH3·H2O=AgOH↓+NH4+;AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O;而常见的盐中只有AgNO3可溶于水,故F为AgNO3;(IV)由③步操作可知B中阴离子应为CO32-,由于此无色无味的气体只能是CO2, B、C、D中能生成沉淀说明不能是HCO3-,而阳离子可是常见的K+、Na+、NH4+等待定(V)同样由②步操作D中能与氨水生成沉淀的无色溶液中常见的为阳离子为Mg2+或Al3+,而阴离子需待下步反应再![]() 确定;(VI)由④步操作生成的沉淀为可能为AgCl、AgBr、AgI、BaSO4、H2SiO3(不合理)等,但限于题干所述中学常用试剂,则沉淀应为AgCl和BaSO4,才不溶于HNO3,一个是与AgNO3结合生成的沉淀,一个是与硫酸结合形成的沉淀,故C应该同时含有Ba2+和Cl-即,C为BaCl2,进而推出D中阴离子应该为SO42-,因为题干所述盐溶液中阴离子均不同,故D为Al2(SO4)3或MgSO4其他解析见答案
确定;(VI)由④步操作生成的沉淀为可能为AgCl、AgBr、AgI、BaSO4、H2SiO3(不合理)等,但限于题干所述中学常用试剂,则沉淀应为AgCl和BaSO4,才不溶于HNO3,一个是与AgNO3结合生成的沉淀,一个是与硫酸结合形成的沉淀,故C应该同时含有Ba2+和Cl-即,C为BaCl2,进而推出D中阴离子应该为SO42-,因为题干所述盐溶液中阴离子均不同,故D为Al2(SO4)3或MgSO4其他解析见答案
【答案】(1)A NH3·H2O或NH3 ;E H2SO4 F AgNO3 C BaCl2
若C作为不能确定的溶液,进一步鉴别的方法合理,同样给分
(2)B Na2CO3或K2CO3 用洁净的铂丝蘸取少量B,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液
D Al2(SO4)3或MgSO4 取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液
洗车安全气囊是德国安![]() 全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另和一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲的化学式为 ,丙的电子式为 。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为 。
(3)单质乙与红棕色粉末发生反应的化学方程式为 ,安全气囊中红棕色粉末的作用是 。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 。
A. KCl B. KNO3 C. Na2S D. CuO
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合物) 。
【解析】
本题知识载体很新鲜,很生活,很化学。简答式的题目首先要进行分析,确定设计的物质及反应才能完成各小题的内容。
题目关键词:粉末分解释放氮气,粉末仅含Na、Fe、N、O,水溶性试验部分溶解,可溶部分为化合物甲,不溶物红棕色可溶于盐酸。13.0g甲完全分解为N2和单质乙,N26.72L,单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另和一种单质。化合物丙与空气接触可转化为可溶性盐。
解题分析:1、粉末由两种物质混合而成。2、红棕色物质可能为Fe2O3\Fe(OH)3等,根据题意只能是Fe2O3。3、甲只有两种元素,且含N,必含Na。3、计算:N(6.72/22.4)*2*14=8.4g,则Na的物质的量为:(13-8.4)/23=0.2mol,N与Na的物质的量之比为:0.6:0.2=3:1,则化合物甲为Na3N。4、在高温下Na与Fe2O3反应的产物为Na2O2和Fe。
【答案】(1)Na3N,![]() (2)2N2O2+4CO2+2H2O=4NaHCO3+O2
(2)2N2O2+4CO2+2H2O=4NaHCO3+O2
 (3)6Na+2Fe2O3=3Na2O2+4Fe ,红色粉末的作用是充当氧化剂,除去氮化钠分解产生的金属钠(金属钠溶于水产生大量的热和碱性有害物质),提供大量的热量用于氮化钠的迅速分解。(4)从氧化性角度分析KNO3、CuO均可,但KNO3本身受热分解,产生氧气与氮气反应。故选择D. CuO。(5)实验目的:检验Na2O2在空气中与水或二氧化碳反应的产物,即检验NaOH和Na2CO3或NaHCO3。实验设计一:实验原理:定量分析法。步骤:1、称量混合固体的质量。2、将混合物加热,并将气体通入澄清石灰水,无气体则无NaHCO3,石灰水变浑浊则有NaHCO3无NaOH,称量石灰水质量变化量mg。3、加入过量盐酸,将产生的气体通入澄清石灰水,称量石灰水质量增加量ng。4、通过m与n的计算获得最终结果。实验设计二:实验原理:测定盐酸用量与产生二氧化碳的量的关系确定混合物成分。1、不产生二氧化碳则混合物只有NaOH。2、开始产生
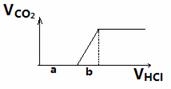
(3)6Na+2Fe2O3=3Na2O2+4Fe ,红色粉末的作用是充当氧化剂,除去氮化钠分解产生的金属钠(金属钠溶于水产生大量的热和碱性有害物质),提供大量的热量用于氮化钠的迅速分解。(4)从氧化性角度分析KNO3、CuO均可,但KNO3本身受热分解,产生氧气与氮气反应。故选择D. CuO。(5)实验目的:检验Na2O2在空气中与水或二氧化碳反应的产物,即检验NaOH和Na2CO3或NaHCO3。实验设计一:实验原理:定量分析法。步骤:1、称量混合固体的质量。2、将混合物加热,并将气体通入澄清石灰水,无气体则无NaHCO3,石灰水变浑浊则有NaHCO3无NaOH,称量石灰水质量变化量mg。3、加入过量盐酸,将产生的气体通入澄清石灰水,称量石灰水质量增加量ng。4、通过m与n的计算获得最终结果。实验设计二:实验原理:测定盐酸用量与产生二氧化碳的量的关系确定混合物成分。1、不产生二氧化碳则混合物只有NaOH。2、开始产生![]() 二氧化碳前,与开始产生二氧化碳直到最大量消耗的盐酸的体积比为1:1则只有Na2CO3。大于1:1则为NaOH与Na2CO3的混合物。小于1:1则为Na2CO3和NaHCO3的混合物。即比较图中a,b的大小。
二氧化碳前,与开始产生二氧化碳直到最大量消耗的盐酸的体积比为1:1则只有Na2CO3。大于1:1则为NaOH与Na2CO3的混合物。小于1:1则为Na2CO3和NaHCO3的混合物。即比较图中a,b的大小。
教与学提示: 题型的难点1是通过定性和定量两种方式确定物质的化学
成分,其中Na3N又是学生很不熟悉的。难点2是氧化还原方程式的书写与配平,及氧化还原原理的应用。难点3是实验设计,通过定量来定性。但,题目设计与问题设计都在平时的练习与讨论中必然会涉及。比如实验设计部分,在省市多次统考中均有有关碳酸盐与酸反应定量问题出现过,或反复练习过。但,在简答的环境中也还是有难度的。解题中要动用到平时知识的积累,决定成败还是在平时。
工业生产纯碱的工艺流程示意图如下:
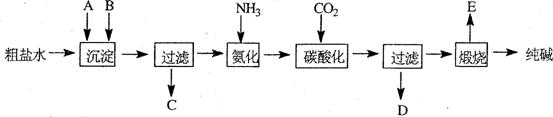
完成下列填空:
1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A B
2)实验室提纯粗盐的实验操作依次为:
取样、 、沉淀、 、 、冷却结晶、 、烘干。
3)工业生产纯碱工艺流程中,碳酸化时产生的现象是 。碳酸化时没有析出碳酸钠晶体,其原因是 。
4)碳酸化后过滤,滤液D最主要的成分是 (填写化学式),检验这一成分的阴离子的具体方法是: 。
5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为: 滤液D加石灰水前先要加热,原因是 。
6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为: (注明你的表达式中所用的有关符号的含义)
【答案】1)Ca(OH)2或CaO;Na2CO3;2)溶解;过滤;蒸发;过滤;3)有晶体析出(或出现浑浊);碳酸钠溶解度![]() 比碳酸氢钠大;4)NH4Cl;取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子;5)NH4++OH-→NH3↑+H2O;防止加石灰水时产生碳酸钙沉淀;6)
比碳酸氢钠大;4)NH4Cl;取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子;5)NH4++OH-→NH3↑+H2O;防止加石灰水时产生碳酸钙沉淀;6)![]() 。
。
【解析】此题考查了物质的提纯、化学实验基本操作、实验结果的处理等知识。1)沉淀剂A源于石灰窑,说明其是生石灰或熟石灰;粗盐中的镁离子和钙离子一般用碳酸钠除去;2)实验室提纯粗盐的整个操作过程为:取样、溶解、沉淀、过滤、蒸发、冷却结晶、过滤、烘干几步;3)纯碱生产中碳酸化时,会看到溶液中析出晶体,这是由于碳酸钠的溶解度大于碳酸氢钠;4)根据操作过程,碳酸后溶液中主要是NH4Cl;检验其中的氯离子时,要经过取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子;5)滤液中主要含有的是氯化铵,其和石灰水反应时:NH4++OH-→NH3↑+H2O;由于滤液中还含有一定量的碳酸氢钠,故此加石灰水前先加热,是为防止加石灰水时产生碳酸钙沉淀;6)假设加热前纯碱的质量为m1,加热后的质量为m2,则加热损失的质量为:m1-m2,则纯碱中碳酸氢钠的质量为:84(m1-m2)/31;故纯碱中含有的碳酸氢钠的质量分数为:![]() 。
。
技巧点拨:解答实验问题时,要首先理清实验目的和实验原理,从实验的安全性、科学性和简约型入手进行解答。对化学实验数据进行处理时,要注意处理的合理性。
本卷还有95题,登录并加入会员即可免费使用哦~

该作品由: 用户卢楠楠分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。