古医典富载化学知识,下述之物见其氧化性者为
A .金 (Au) : “ 虽被火亦未熟 "
B .石灰 (CaO) : “ 以水沃之,即热蒸而解 ”
C .石硫黄 (S) : “ 能化 …… 银、铜、铁,奇物 ”
D .石钟乳 ( ) : “ 色黄,以苦酒 ( 醋 ) 洗刷则白 ”
C
【详解】 A .金 “ 虽被火亦未熟 ” 是指金单质在空气中被火灼烧也不反应,反应金的化学性质很稳定,与其氧化性无关, A 不合题意;
B .石灰 (CaO):“ 以水沃之,即热蒸而解 ” 是指 CaO+H 2 O=Ca(OH) 2 ,反应放热,产生大量的水汽,而 CaO 由块状变为粉末状,未发生氧化还原反应,与其氧化性无关, B 不合题意;
C .石硫黄即 S : “ 能化 …… 银、铜、铁,奇物 ” 是指 2Ag+S Ag 2 S 、 Fe+S
FeS 、 2Cu+S
Cu 2 S ,反应中 S 作氧化剂,与其氧化性有关, C 符合题意;
D .石钟乳 (CaCO 3 ) : “ 色黄,以苦酒 ( 醋 ) 洗刷则白 ” 是指 CaCO 3 +2CH 3 COOH=(CH 3 COO) 2 Ca+H 2 O+CO 2 ↑ ,未发生氧化还原反应,与其氧化性无关, D 不合题意;
故答案为: C 。
下列试剂实验室保存方法错误的是
A .浓硝酸保存在棕色细口瓶中 B .氢氧化钠固体保存在广口塑料瓶中
C .四氯化碳保存在广口塑料瓶中 D .高锰酸钾固体保存在棕色广口瓶中
C
【详解】 A .由于浓硝酸见光易分解,故浓硝酸需保存在棕色细口瓶中避光保存, A 正确;
B .氢氧化钠固体能与玻璃中的 SiO 2 反应,故氢氧化钠固体保存在广口塑料瓶中, B 正确;
C .四氯化碳是一种有机溶剂,易挥发,且能够溶解塑料,故其不能保存在广口塑料瓶中,应该保存在细口玻璃瓶中, C 错误;
D .高锰酸钾固体受热后易分解,故需在棕色广口瓶中、阴冷处密封保存, D 正确;
故答案为: C 。
、
的半衰期很短,自然界中不能稳定存在。人工合成反应如下:
;
。下列说法正确的是
A . X 的中子数为 2
B . X 、 Y 互为同位素
C . 、
可用作示踪原子研究化学反应历程
D .自然界不存在 、
分子是因其化学键不稳定
B
【详解】根据质量守恒可知, X 微粒为 , Y 微粒为
,据此分析解题。
A. 由分析可知, X 微粒为 ,根据质量数等于质子数加中子数可知,该微粒的中子数为 4 , A 错误;
B. 由分析可知, X 微粒为 , Y 微粒为
,二者具有相同的质子数而不同的中子数的原子,故互为同位素, B 正确;
C. 由题干信息可知, 与
的半衰期很短,故不适宜用作示踪原子研究化学反应历程, C 错误;
D. 自然界中不存在 与
并不是其化学键不稳定,而是由于
与
的半衰期很短,很容易发生核变化,转化为气体其他原子, O=O 的键能与形成该键的核素无关, D 错误;
故答案为: B 。
下列高分子材料制备方法正确的是
A .聚乳酸 (  ) 由乳酸经加聚反应制备
) 由乳酸经加聚反应制备
B .聚四氟乙烯 ( ![]() ) 由四氟乙烯经加聚反应制备
) 由四氟乙烯经加聚反应制备
C .尼龙 (
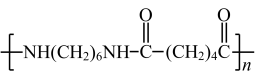 ) 由己胺和己酸经缩聚反应制备
) 由己胺和己酸经缩聚反应制备
D .聚乙烯醇 ( 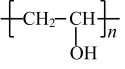 ) 由聚乙酸乙烯酯 (
) 由聚乙酸乙烯酯 ( 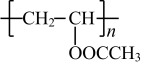 ) 经消去反应制备
) 经消去反应制备
B
【详解】 A .聚乳酸 ( 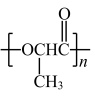 ) 是由乳酸 [HOCH(CH 3 )COOH] 分子间脱水缩聚而得,即发生缩聚反应, A 错误;
) 是由乳酸 [HOCH(CH 3 )COOH] 分子间脱水缩聚而得,即发生缩聚反应, A 错误;
B .聚四氟乙烯 ( ![]() ) 是由四氟乙烯 (CF 2 =CF 2 ) 经加聚反应制备, B 正确;
) 是由四氟乙烯 (CF 2 =CF 2 ) 经加聚反应制备, B 正确;
C .尼龙 -66( 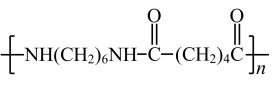 ) 是由己二胺和己二酸经过缩聚反应制得, C 错误;
) 是由己二胺和己二酸经过缩聚反应制得, C 错误;
D .聚乙烯醇 ( 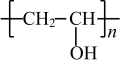 ) 由聚乙酸乙烯醇酯 (
) 由聚乙酸乙烯醇酯 (  ) 发生水解反应制得, D 错误;
) 发生水解反应制得, D 错误;
故答案为: B 。
、
属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在
键、
键。下列说法错误的是
A . 的熔点高于
B .晶体中所有化学键均为极性键
C .晶体中所有原子均采取 杂化 D .晶体中所有原子的配位数均相同
A
【分析】 Al 和 Ga 均为第 ⅢA 元素, N 属于第 ⅤA 元素, AlN 、 GaN 的成键结构与金刚石相似,则其为共价晶体,且其与金刚石互为等电子体,等电子体之间的结构和性质相似。 AlN 、 GaN 晶体中, N 原子与其相邻的原子形成 3 个普通共价键和 1 个配位键。
【详解】 A .因为 AlN 、 GaN 为结构相似的共价晶体,由于 Al 原子的半径小于 Ga , N—Al 的键长小于 N—Ga 的,则 N—Al 的键能较大,键能越大则其对应的共价晶体的熔点越高,故 GaN 的熔点低于 AlN , A 说错误;
B .不同种元素的原子之间形成的共价键为极性键,故两种晶体中所有化学键均为极性键, B 说法正确;
C .金刚石中每个 C 原子形成 4 个共价键(即 C 原子的价层电子对数为 4 ), C 原子无孤电子对,故 C 原子均采取 sp 3 杂化;由于 AlN 、 GaN 与金刚石互为等电子体,则其晶体中所有原子均采取 sp 3 杂化, C 说法正确;
D .金刚石中每个 C 原子与其周围 4 个 C 原子形成共价键,即 C 原子的配位数是 4 ,由于 AlN 、 GaN 与金刚石互为等电子体,则其晶体中所有原子的配位数也均为 4 , D 说法正确。
综上所述,本题选 A 。
本卷还有15题,登录并加入会员即可免费使用哦~

该作品由: 用户核查分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。