化学与生活密切相关。下列叙述正确的是
A .漂白粉与盐酸可混合使用以提高消毒效果 B .温室气体是形成酸雨的主要物质
C .棉花、麻和蚕丝均为碳水化合物 D .干冰可用在舞台上制造 “ 云雾 ”
D
【详解】 A .漂白粉的有效成分次氯酸钙与盐酸混合,会发生氧化还原反应生成有毒的氯气,两者不能混合使用, A 错误;
B .温室气体主要是指二氧化碳,二氧化碳不是形成酸雨的主要物质,形成酸雨的主要物质是硫氧化物、氮氧化物等, B 错误;
C .棉花、麻来源于植物,主要成分均是纤维素,为碳水化合物,但蚕丝来源于动物,主要成分是蛋白质,蛋白质不是碳水化合物, C 错误;
D .干冰是固态的二氧化碳,干冰升华时,吸收大量的热,使周围温度降低,大量的水蒸气凝结成了小液滴,形成 “ 云雾 ” 效果, D 正确;
答案选 D 。
辅酶 具有预防动脉硬化的功效,其结构简式如下。下列有关辅酶
的说法正确的是
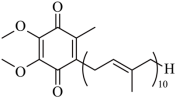
A .分子式为 B .分子中含有 14 个甲基
C .分子中的四个氧原子不在同一平面 D .可发生加成反应,不能发生取代反应
B
【详解】 A .由该物质的结构简式可知,其分子式为 C 59 H 90 O 4 , A 错误;
B .由该物质的结构简式可知,键线式端点代表甲基, 10 个重复基团的最后一个连接 H 原子的碳是甲基,故分子中含有 1+1+1+10+1=14 个甲基, B 正确;
C .双键碳以及与其相连的四个原子共面,羰基碳采取 sp 2 杂化,羰基碳原子和与其相连的氧原子及另外两个原子共面,因此分子中的四个氧原子在同一平面上, C 错误;
D .分子中有碳碳双键,能发生加成反应,分子中含有甲基,能发生取代反应, D 错误;
答案选 B 。
能正确表示下列反应的离子方程式为
A .硫化钠溶液和硝酸混合: S 2- +2H + =H 2 S↑
B .明矾溶液与过量氨水混合: Al 3+ +4NH 3 +2H 2 O=AlO +4NH
C .硅酸钠溶液中通入二氧化碳: SiO +CO 2 +H 2 O=HSiO
+HCO
D .将等物质的量浓度的 Ba(OH) 2 和 NH 4 HSO 4 溶液以体积比 1∶2 混合: Ba 2+ +2OH - +2H + +SO =BaSO 4 ↓+2H 2 O
D
【详解】 A .硝酸具有强氧化性,可以将 S 2- 氧化为 S 单质,自身根据其浓度大小还原为 NO 或 NO 2 ,反应的离子方程式为 4H + +2NO +S 2- =S↓+2NO 2 ↑+2H 2 O( 浓 ) 或 8H + +2NO
+3S 2- =3S↓+2NO↑+4H 2 O( 稀 ) , A 错误;
B .明矾在水中可以电离出 Al 3+ ,可以与氨水电离出的 OH - 发生反应生成 Al(OH) 3 ,但由于氨水的碱性较弱,生成的 Al(OH) 3 不能继续与弱碱发生反应,故反应的离子方程式为 Al 3+ +3NH 3 ·H 2 O=Al(OH) 3 ↓+3NH , B 错误;
C .硅酸的酸性小于碳酸,向硅酸钠溶液中通入二氧化碳时,生成硅酸沉淀,二氧化碳则根据其通入的量的多少反应为碳酸根或碳酸氢根,反应的离子方程式为 SiO +H 2 O+CO 2 =H 2 SiO 3 ↓+CO
(CO 2 少量 ) 或 SiO
+2H 2 O+2CO 2 =H 2 SiO 3 ↓+2HCO
(CO 2 过量 ) , C 错误;
D .将等物质的量浓度的 Ba(OH) 2 与 NH 4 HSO 4 溶液以体积比 1 : 2 混合, Ba(OH) 2 电离出的 OH - 与 NH 4 HSO 4 电离出的 H + 反应生成水, Ba(OH) 2 电离出的 Ba 2+ 与 NH 4 HSO 4 电离出的 SO 反应生成 BaSO 4 沉淀,反应的离子方程为为 Ba 2+ +2OH - +2H + +SO
=BaSO 4 ↓+2H 2 O , D 正确;
故答案选 D 。
一种水性电解液 Zn-MnO 2 离子选择双隔膜电池如图所示 (KOH 溶液中, Zn 2+ 以 Zn(OH) 存在 ) 。电池放电时,下列叙述错误的是

A . Ⅱ 区的 K + 通过隔膜向 Ⅲ 区迁移
B . Ⅰ 区的 SO 通过隔膜向 Ⅱ 区迁移
C . MnO 2 电极反应: MnO 2 +2e - +4H + =Mn 2+ +2H 2 O
D .电池总反应: Zn+4OH - +MnO 2 +4H + =Zn(OH) +Mn 2+ +2H 2 O
A
【分析】根据图示的电池结构和题目所给信息可知, Ⅲ 区 Zn 为电池的负极,电极反应为 Zn-2e - +4OH - =Zn(OH) , Ⅰ 区 MnO 2 为电池的正极,电极反应为 MnO 2 +2e - +4H + =Mn 2+ +2H 2 O ;电池在工作过程中,由于两个离子选择隔膜没有指明的阳离子隔膜还是阴离子隔膜,故两个离子隔膜均可以通过阴、阳离子,因此可以得到 Ⅰ 区消耗 H + ,生成 Mn 2+ , Ⅱ 区的 K + 向 Ⅰ 区移动或 Ⅰ 区的 SO
向 Ⅱ 区移动, Ⅲ 区消耗 OH - ,生成 Zn(OH)
, Ⅱ 区的 SO
向 Ⅲ 区移动或 Ⅲ 区的 K + 向 Ⅱ 区移动。据此分析答题。
【详解】 A .根据分析, Ⅱ 区的 K + 只能向 Ⅰ 区移动, A 错误;
B .根据分析, Ⅰ 区的 SO 向 Ⅱ 区移动, B 正确;
C . MnO 2 电极的电极反应式为 MnO 2 +2e - +4H + =Mn 2+ +2H 2 O , C 正确;
D .电池的总反应为 Zn+4OH - +MnO 2 +4H + =Zn(OH) +Mn 2+ +2H 2 O , D 正确;
故答案选 A 。
为阿伏加德罗常数的值,下列说法正确的是
A . 25℃ , 下,
氢气中质子的数目为
B . 溶液中,
的数目为
C . 苯甲酸完全燃烧,生成
的数目为
D .电解熔融 ,阴极增重
,外电路中通过电子的数目为
C
【详解】 A . 25℃ 、 101kPa 不是标准状况,不能用标况下的气体摩尔体积计算氢气的物质的量,故 A 错误;
B . Al 3+ 在溶液中会发生水解生成 Al(OH) 3 ,因此 2.0L 1.0 mol/L 的 AlCl 3 溶液中 Al 3+ 数目小于 2.0N A ,故 B 错误;
C .苯甲酸燃烧的化学方程式为 , 1mol 苯甲酸燃烧生成 7molCO 2 ,则 0.2mol 苯甲酸完全燃烧生成 1.4molCO 2 ,数目为 1.4N A ,故 C 正确;
D .电解熔融 CuCl 2 时,阳极反应为 ,阴极反应为
,阴极增加的重量为 Cu 的质量, 6.4gCu 的物质的量为 0.1mol ,根据阴极反应可知,外电路中通过电子的物质的量为 0.2mol ,数目为 0.2N A ,故 D 错误;
答案选 C 。
本卷还有7题,登录并加入会员即可免费使用哦~

该作品由: 用户陈志敏分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。