下列叙述正确的是
A .配位键在形成时,是由成键双方各提供一个电子形成共用电子对
B .最外层电子排布式为 ns 1 的原子一定属于 ⅠA 族元素,也一定属于 S 区
C . (HO) 2 HPO 为二元弱酸
D . CH 4 分子中的 sp 3 杂化轨道是由 4 个 H 原子的 1s 轨道和 C 原子的 2p 轨道混合起来而形成的
C
【详解】 A .配位键在形成时,中心原子提供空轨道,配体提供孤对电子,所以共用电子对是由配体提供的, A 错误;
B . 29 号 Cu 的价电子排布式为 : 3dl 10 4s 1 ,位于周期表 ds 区, B 错误;
C . P 的含氧酸中,磷酸是最强酸,但却是弱酸,根据 (HO) 2 HPO 结构可知,其为二元弱酸, C 正确;
D . CH 4 分子中的 sp 3 杂化轨道是由 C 原子的一个 2s 轨道与三个 2p 轨道杂化而成的, D 错误;
故选 C 。
某元素 X 的逐级电离能如图所示,下列说法正确的是
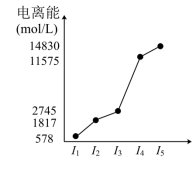
A . X 元素可能为 +4 价
B . X 的最高价氢氧化物一定为强碱
C . X 为第五周期元素
D . X 与氯气反应生成化合物为 XCl 3
D
【分析】根据电离能图知,第三电离能和第四电离能之间的差距最大,所以该原子最外层有 3 个电子,属于第 ⅢA 族元素。
【详解】 A . X 元素最外层有 3 个电子,可能为 +3 价,故 A 错误;
B . X 元素最外层有 3 个电子,属于第 ⅢA 族元素,则 X 的最高价氢氧化物不可能是强碱,故 B 错误;
C .周期数 = 核外电子层数,图象中没有显示 X 原子有多少电子层,因此无法确定该元素位于第几周期,故 C 错误;
D .该主族元素最外层有 3 个电子,在反应中容易失去 3 个电子形成 X 3+ ,所以 X 与氯反应时可能生成 XCl 3 ,故 D 正确;
故答案选 D 。
下列说法正确的是
A . N 2 、 O 2 和 Cl 2 分子中均既含有 σ 键,又含有 π 键
B . Na 的核外电子排布由 1s 2 2s 2 2p 6 3s 1 →1s 2 2s 2 2p 6 的变化需要吸收能量
C .氢原子的电子云图中小黑点表示电子的运动轨迹
D .电离下列状态的铝的最外层一个电子: 1s 2 2s 2 2p 6 3s 1 比 1s 2 2s 2 2p 6 3s 2 所需能量更少
B
【详解】 A . N 2 的结构式为 N≡N ,既含有 σ 键,又含有 π 键, O 2 的结构式为 O=O ,既含有 σ 键,又含有 π 键, Cl 2 的结构式为 Cl-Cl ,只含 σ 键、不含 π 键, A 错误;
B .核外电子排布由 1s 2 2s 2 2p 6 3s 1 →1s 2 2s 2 2p 6 的变化,为钠原子形成钠离子,吸收能量, B 正确;
C .氢原子的电子云图中,小黑点表示电子在核外空间出现机会的多少,不表示电子的运动轨迹, C 错误;
D . 1s 2 2s 2 2p 6 3s 2 为铝的 +1 价气态离子, 1s 2 2s 2 2p 6 3s 1 为铝的 +2 价气体离子,则 +2 价铝失去电子需要的能量多, D 错误;
故选 B 。
下列说法正确的是
A .化合物 NH 4 Cl 和 Fe(CO) 5 都含有配位键
B .最外层电子排布式为 ns 2 的原子属于第 ⅡA 族元素
C . SO 2 、 CS 2 、 HBr 都是直线形分子
D .主族元素的原子形成单原子离子时的化合价数都和它的族序数相等
A
【详解】 A .氯化铵分子中氮原子含有孤电子对,氢离子提供空轨道,化合物 NH 4 Cl 可以形成配位键, Fe(CO) 5 中 Fe 原子提供空轨道, CO 提供孤对电子,可以形成配位键, A 正确;
B .某元素基态原子的最外层电子排布式为 ns 2 ,可能为 Mg 、 Zn 、 He 等,可能在 IIA 族、副族或零族,可能为金属元素也可能为非金属元素, B 错误;
C . SO 2 的中心原子 S 的价层电子对数 =2+ =3 ,含有一个孤电子对,空间构型为 V 型, CS 2 与 CO 2 互为等电子体,结构为 S=C=S ,空间构型为直线型, HBr 分子中 H 原子与 Br 原子间共用一对电子对,空间构型为直线型, C 错误;
D .主族元素的原子形成单原子阳离子时的化合价等于其族序数,但形成阴离子时的化合价不一定等于其族序数,如氧离子、氯离子, D 错误;
故答案为: A 。
下列叙述正确的是
A .基态铝原子核外有三个单电子 B .铜原子的外围电子排布式是: 3d 9 4s 2
C . [Ar]3d 2 4s 2 是基态钛原子的电子排布 D .铬原子的电子排布式是: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
C
【详解】 A .基态铝原子的核外电子排布式为: 1s 2 2s 2 2p 6 3s 2 3p 1 ,有 1 个单电子,故 A 错误;
B .铜原子的价电子排布式是 3d 10 4s 1 ,而不是 3d 9 4s 2 ,故 B 错误;
C .钛为 22 号元素,基态电子排布式为: [Ar]3d 2 4s 2 ,故 C 正确;
D . Cr 为 24 号元素,原子核外有 24 个电子,所以核外电子排布式为: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 ,故 D 错误;
故选 C 。
本卷还有30题,登录并加入会员即可免费使用哦~

该作品由: 用户余靖知分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。