W 、 X 、 Y 、 Z 为原子序数依次增大的短周期主族元素。 W 、 X 、 Y 组成的一种化合物如图。下列说法正确的是
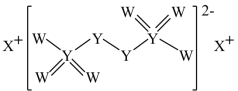
A .四种元素中 X 的原子半径最大,简单离子半径最小
B .最高化合价: Z>Y=W>X
C .氧化物对应水化物的酸性: Z>Y
D .气态氢化物的稳定性: Y>Z
A
【分析】 W 、 X 、 Y 、 Z 为原子序数依次增大的短周期主族元素。根据 W 、 X 、 Y 组成的化合物的结构图可知, W 和 Y 为第 ⅥA 族元素,所以 W 为 O , Y 为 S ,则 Z 为 Cl ; X 能形成 +1 价离子,则 X 为 Na 。
【详解】 A .一般地,电子层数越多,半径越大,电子层数相同,质子数越多,半径越小。所以四种元素中 Na 的原子半径最大,简单离子半径最小,故 A 正确;
B . S 的最高正价为 +6 价, O 没有 +6 价,故 B 错误;
C .最高价氧化物对应的水化物的酸性 HClO 4 >H 2 SO 4 ,没有指明最高价,如 HClO 的酸性弱于 H 2 SO 4 ,故 C 错误;
D .非金属性越强,简单气态氢化物的稳定性越强,同周期元素从左到右,非金属性逐渐增强,所以 HCl 的稳定性强于 H 2 S ,故 D 错误;
故选 A 。
如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是

A .该元素的原子序数是 14 B . 28.09 是硅元素的质量数
C .该元素所有核素的质子数均为 14 D . 、
、
三种核素互称同位素
B
【分析】硅为元素周期表 14 号元素,原子序数为 14 , 28.09 表示元素相对原子质量。
【详解】 A .硅为元素周期表 14 号元素,原子序数为 14 ,故 A 正确;
B . 28.09 表示元素相对原子质量,故 B 错误;
C .质子数=原子序数= 14 ,该元素所有核素的质子数均为 14 ,故 C 正确;
D .具有相同质子数,不同中子数的同一元素的不同核素互为同位素,所以 、
、
三种核素互称同位素,故 D 正确;
故答案选 B 。
X 、 Y 、 Z 、 M 、 Q 为前 20 号主族元素,其原子序数依次增大。 X 的核外电子数等于其周期数, X 2 Y 是最常用的溶剂, Z 的最外层电子数是 Y 电子总数的一半, Q 为前四周期金属性最强的元素。下列说法一定正确的是
A .气态氢化物的稳定性: B . M 单质常温下为固体
C . ZY 2 与 Q 2 Y 的化学键类型相同 D .简单离子半径:
D
【分析】 X 、 Y 、 Z 、 M 、 Q 为前 20 号主族元素,其原子序数依次增大。 X 的核外电子数等于其周期数,则 X 为 H , X 2 Y 是最常用的溶剂水,则 Y 为 O , Z 的最外层电子数是 Y 电子总数的一半,则 Z 为 Si , Q 为前四周期金属性最强的元素,则 Q 为 K ,据此 M 为 P 、 S 、 Cl , 则 X=H , Y=O , Z=Si , M=P 、 S 、 Cl , Q=K 。
【详解】 A . Si 的非金属性小于 P 、 S 、 Cl , SiH 4 的稳定性小于 PH 3 、 H 2 S 、 HCl , A 错误;
B . M 的单质是 P 、 S 或 Cl 2 ,其中 Cl 2 常温下为气体, B 错误;
C . ZY 2 为 SiO 2 含共价键, Q 2 Y 为 K 2 O 含离子键,二者化学键类型不同, C 错误;
D . P 3- 、 S 2- 、 Cl - 与 K + 具有相同的电子层结构,随核电荷数增大,离子半径减小, D 正确;
答案选 D 。
某化合物的结构如图所示,其中 X 、 Y 、 Z 、 Q 、 W 为原子序数依次增大的五种短周期元素, Q 核外最外层电子数与 Y 核外电子总数相同, X 的原子半径是元素周期表中最小的,下列叙述正确的是
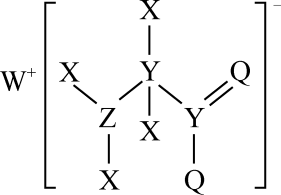
A . WX 溶于水后溶液呈中性 B .氧化物沸点; Y>Z
C . Z 的氧化物对应的水化物是一元强酸 D . X 、 Y 、 Z 、 W 均能和 Q 形成两种或两种以上化合物
D
【分析】由图分析, X 只能形成一个共价键,又知 X 的原子半径是元素周期表中最小的,故 X 为 H ; W 为五种短周期元素中原子序数最大的,且可形成 +1 价的离子,应为 Na ; Y 可形成四个共价键,则 Y 为 C , Q 核外最外层电子数与 Y 核外电子总数相同,则 Q 为 O , Z 为 N 。
【详解】 A . WX 为 NaH ,溶于水会得到 NaOH 溶液,显碱性, A 项错误;
B . C 的氧化物有多种 CO 、 CO 2 等, N 的氧化物有 NO 、 NO 2 、 N 2 O 3 、 N 2 O 5 等,无法比较, B 项错误;
C . Z 的氧化物有多种,如 N 2 O 3 对应的水化物 HNO 2 为弱酸, C 项错误;
D . H 和 O 形成 H 2 O 、 H 2 O 2 , Na 和 O 形成 Na 2 O 、 Na 2 O 2 , C 和 O 形成 CO 、 CO 2 , N 和 O 形成 NO 、 NO 2 、 N 2 O 3 、 N 2 O 5 , D 项正确;
答案选 D 。
有反应 。下列说法正确的是
A .第一电离能大小: B .电负性大小:
C .热稳定性: D .离子半径:
C
【详解】 A .氮原子的价电子排布式是 2s 2 2p 5 , p 电子处于半充满状态,较稳定,氧原子的价电子排布式是 2s 2 2p 6 ,所以第一电离能大小: , A 项错误;
B .同一周期,从左到右,元素电负性逐渐增大,所以碳的电负性小于氧元素, B 项错误;
C .非金属性越强,其元素形成的简单氢化物越稳定,所以非金属性: O > N ,热稳定性 , C 项正确;
D .微粒半径大小比较的方法如下:电子层越多,半径越大,电子层数一样,核电荷数越大,半径越小。钠离子和氧离子的电子层数一样多,钠离子的核电荷数大,半径小, D 项错误;
故答案选 C 。
本卷还有30题,登录并加入会员即可免费使用哦~

该作品由: 用户王十朋分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。