下列说法中不正确的是
① 将 放入水中不能导电,所以
是非电解质
② 氨溶于水得到的溶液导电性较差,所以氨水是弱电解质
③NaCl 溶液能导电是因为在通电条件下,离解为自由移动的离子
④ 相同温度下的 0.01mol/L 和 0.1mol/L 溶液中 pH 的差小于 1
⑤ 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A . ①④ B . ①②③⑤ C . ①④⑤ D .全部
B
【详解】 ① 硫酸钡是难溶于水的盐,在水中电离程度很小,几乎不导电,但溶解部分完全电离,因此硫酸钡属于强电解质,故 ① 错误;
② 氨水属于混合物,氨水既不是电解质也不是非电解质,故 ② 错误;
③ 氯化钠在水中电离,不需要通电,是在水分子作用下离解成 Na + 和 Cl - ,故 ③ 错误;
④CH 3 COOH CH 3 COO - +H + , c(CH 3 COO - ) 近似等于 c(H + ), 醋酸属于弱酸,电离程度微弱,因此达到电离平衡时, c(CH 3 COOH) 近似等于分析浓度, 0.01mol/L 醋酸溶液中 c(H + )=
mol/L , 0.1mol/L 醋酸溶液中 c(H + )=
mol/L ,因此两溶液的 pH 相差小于 1 ,故 ④ 正确;
⑤ 电解质溶液的导电能力与离子浓度、所带电荷数等有关,与是否是强弱电解质无关,故 ⑤ 错误;
综上所述, ①②③⑤ 符合题意,选项 B 符合题意;
答案为 B 。
下列物质在水溶液中的电离方程式正确的是
A . B .
C . D .
C
【详解】 A . 次氯酸钠是强电解质,在溶液中完全电离出钠离子和次氯酸根离子,故电离方程式为 ,故 A 错误;
B . 氢氧硫酸是强电解质,在溶液中能完全电离为钡离子和氢氧根离子,故电离方程式为 ,故 B 错误;
C . 醋酸铵是强电解质,在溶液中能完全电离为铵根离子和醋酸根,故电离方程式为 ,故 C 正确;
D . 硫酸氢钠在溶液中完全电离为钠离子、氢离子和硫酸根,故硫酸氢钠的电离方程式为 ,故 D 错误。
故选 C 。
使用如图装置 ( 搅拌装置略 ) 探究溶液离子浓度变化,灯光变化 不可能 出现 “ 亮-暗 ( 或灭 ) -亮 ” 现象的是
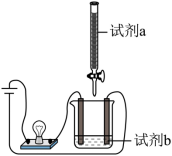
| 选项 | A | B | C | D |
| 试剂 a | CuSO 4 | NaHSO 4 | H 2 SO 4 | CH 3 COOH |
| 试剂 b | Ba(OH) 2 | Ba(OH) 2 | Ba(OH) 2 | Ba(OH) 2 |
A . A B . B C . C D . D
D
【分析】溶液导电的原因是存在自由移动的离子;灯光变化出现 “ 亮-暗 ( 或灭 ) -亮 ” 现象说明溶液中离子浓度先减小后变大;
【详解】 A . Ba(OH) 2 与 CuSO 4 发生离子反应: Ba 2+ +2OH - +Cu 2+ + =BaSO 4 ↓+Cu(OH) 2 ↓ ,随着反应的进行,溶液中自由移动的离子浓度减小,灯泡变暗,当二者恰好反应时,溶液中几乎不存在自由移动的微粒,灯泡完全熄灭。当 CuSO 4 溶液过量时,其电离产生的 Cu 2+ 、
导电,使灯泡逐渐又变亮, A 不符合题意;
B .两者生成硫酸钡沉淀和水,溶液中离子浓度减小,硫酸氢钠溶液过量后,离子浓度又变大, B 不符合题意;
C . Ba(OH) 2 与 H 2 SO 4 发生离子反应: Ba 2+ +2OH - +2H + + =BaSO 4 ↓+2H 2 O ,随着反应的进行,溶液中自由移动的离子浓度减小,灯泡变暗,当二者恰好反应时,溶液中几乎不存在自由移动的微粒,灯泡完全熄灭。当 H 2 SO 4 溶液过量时,其电离产生的 H + 、
导电,使灯泡逐渐又变亮, C 不符合题意;
D .醋酸为弱电解质,加入氢氧化钡后生成醋酸钡,反应后自由移动的离子浓度增大,溶液导电能力增强,灯泡更明亮,不出现亮 — 灭 ( 或暗 )— 亮的变化, D 符合题意;
故选 D 。
某小组在实验室探究 Ba(OH) 2 溶液与稀硫酸反应的实质。向 Ba(OH) 2 溶液中滴加稀硫酸,测定导电率的变化如图所示。下列说法不正确的是
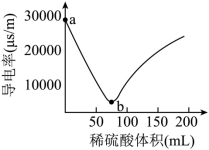
A . Ba(OH) 2 的电离方程式为 Ba(OH) 2 =Ba 2+ +2OH -
B . a ~ b 段发生反应的离子方程式为
C . b 点时 Ba(OH) 2 恰好反应完全
D . b 点之后导电率曲线上升的原因是稀硫酸过量,离子浓度又逐渐增大
B
【分析】向 Ba(OH) 2 溶液中加入 H 2 SO 4 ,二者会发生中和反应: Ba(OH) 2 +H 2 SO 4 =BaSO 4 ↓+2H 2 O ,在 b 点二者会恰好反应产生 BaSO 4 沉淀、 H 2 O ,溶液中自由移动的离子浓度几乎为 0 ,导电率几乎为 0 ,后硫酸过量,溶液中过量 H 2 SO 4 电离产生的 H + 、 ,随着 H2SO4 物质的量的增多,溶液中自由移动的离子浓度增大,溶液的导电能力增强。
【详解】 A . Ba(OH) 2 是可溶性二元强碱,在水中电离产生 Ba 2+ 、 OH - ,故其电离方程式为 Ba(OH) 2 =Ba 2+ +2OH - , A 正确;
B .不符合物质反应的微粒数目比。 b 点二者恰好反应,在 a ~ b 段发生反应的离子方程式为: Ba 2+ +2OH - +2H + + =BaSO4↓+2H 2 O , B 错误;
C . b 点时 Ba(OH) 2 与 H 2 SO 4 恰好反应 BaSO 4 沉淀、 H 2 O ,溶液中自由移动的离子浓度急剧下降,几乎为 0 ,导电率急剧减小, C 正确;
D . b 点之后导电率曲线上升的原因是稀硫酸过量,过量的硫酸电离产生的离子,使溶液中自由移动的离子浓度又逐渐增大,因而导电能力逐渐增强, D 正确;
故合理选项是 B 。
某化学兴趣小组,按照图 Ⅰ 、图 Ⅱ 接好线路进行化学实验。下列有关说法正确的是
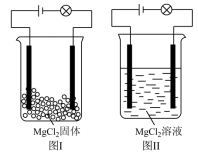
A .图 Ⅰ 、图 Ⅱ 中灯泡都发亮
B . 溶液是电解质
C . 在水溶液中可以电离出自由移动的离子
D . 只有在溶液中才能导电
C
【详解】 A . 固体中离子不能自由移动,不导电,故图 Ⅰ 中灯泡不亮;
在溶液中电离生成能够自由移动的
和
,故图 Ⅱ 中灯泡发亮, A 错误;
B . 溶液是混合物, B 错误;
C . 在溶液中电离生成能够自由移动的
和
, C 正确;
D . 在熔融状态下也能导电, D 错误;
故选 C 。
本卷还有30题,登录并加入会员即可免费使用哦~

该作品由: 用户小小分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。