下列化合物的性质与用途具有对应关系的是
A . 具有还原性,可用于葡萄酒的抗氧化剂
B . 熔点很高,可用于冶炼金属铝
C . 具有还原性,可用作制冷剂
D . 具有氧化性,可用于加快
分解
A
【详解】 A . SO 2 中硫元素化合价为+4价,为中间价态,所以 SO 2 既有氧化性又有还原性,可利用 SO 2 较强的还原性做防腐剂, A 正确;
B .冶炼金属铝用氧化铝而不用氯化铝的原因是因为氧化铝为离子化合物,氯化铝为共价化合物,氧化铝熔点很高,所以可做耐热材料, B 选项性质与用途不对应, B 错误;
C .液氨易汽化吸收大量热,所以可以做制冷剂,与 NH 3 的还原性无关, C 选项性质与用途不对应, C 错误;
D .催化剂通过改变反应的途径来加快反应速率,但在反应前后其性质、质量均不变, MnO 2 能催化 H 2 O 2 的分解与 MnO 2 的氧化性无关, D 错误;
故选 A 。
将使用过的废铝热剂 ( 主要成分为 ,含少量
) 再生制取金属铝的工艺流程如图所示。下列说法中正确的是
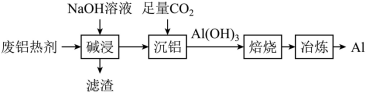
A . “ 碱浸 ” 时,发生反应的化学方程式为
B . “ 沉铝 ” 时,可以用足量 HCl 代替
C .冶炼金属铝的方法为热还原法
D .该流程中各步均不涉及氧化还原反应
A
【详解】 A . 与
反应
,选项 A 正确;
B .足量 会使
溶解,不可代替,选项 B 错误;
C .冶炼金属铝为电解法,选项 C 错误;
D . 属于氧化还原反应,选项 D 错误;
答案选 A 。
工业上用铝土矿 ( 主要成分 ,含
等杂质 ) 冶炼铝的主要流程如下:
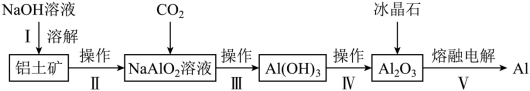
( 注: 碱溶时转变为铝硅酸钠沉淀 )
下列叙述错误的是
A .操作 I 增大 溶液用量可提高
的浸取率
B .操作 II 、 III 均需用到分液漏斗,操作 Ⅳ 需用到坩埚
C .通入过量 的离子方程式为
D .加入的冰晶石目的是降低 的熔融温度
B
【分析】 Al 2 O 3 、 Fe 2 O 3 和硫酸反应,选择氢氧化钠,将氧化铝和 Fe 2 O 3 分离出来,将氧化铝溶解为偏铝酸钠,固体难溶物是氧化铁和铝硅酸钠沉淀,滤液为偏铝酸钠,通二氧化碳来获得氢氧化铝沉淀,发生 CO 2 +AlO +2H 2 O═Al(OH) 3 ↓+HCO
,氢氧化铝加热分解生成氧化铝,电解可得铝,以此解答该题。
【详解】 A .增大 NaOH 溶液用量,可使氧化铝完全反应,提高氧化铝的浸取率, A 正确;
B .操作 Ⅱ 、 Ⅲ 用于分离固体和液体,为过滤操作,不用分液漏斗,操作 Ⅳ 可使氢氧化铝转化为氧化铝,则为灼烧, B 错误;
C .通入过量 CO 2 的离子方程式为 CO 2 +AlO +2H 2 O═Al(OH) 3 ↓+HCO
, C 正确;
D .氧化铝熔点较高,加入冰晶石,可降低熔点,利于熔化, D 正确;
故选 B 。
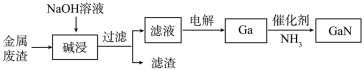
Ga 与 Al 同主族,化学性质相似。从某金属废渣 ( 主要含 、
) 中提取镓并制备 GaN 的工艺流程如下。下列说法不正确的是
A . “ 碱浸 ” 时发生反应的离子方程式:
B .滤渣的主要成分为
C .电解过程中 元素被还原
D .制备 的反应为
,
作氧化剂
B
【分析】金属废渣 ( 主要含 、
) 加入氢氧化钠,
与氢氧化钠反应,
不与氢氧化钠反应,过滤得到滤渣为氧化铁,滤液中为氢氧化钠、 NaGaO 2 ,滤液进行电解得到 Ga , Ga 和氨气反应生成 GaN ,据此分析解题。
【详解】 A . Ga 与 Al 同主族,化学性质相似,根据氧化铝与氢氧化钠应方程式得到 “ 碱浸 ” 过程中 与 NaOH 发生反应的离子方程式为
,故 A 正确;
B . 由分析知,滤渣的主要成分为 ,故 B 错误;
C .电解时, NaGaO 2 得电子转化为 Ga ,发生还原反应,在阴极发生反应,故 C 正确;
D . 制备 的反应为
, GaN 中 N 为 -3 价, Ga 为 +3 价,故 NH 3 中的 N 元素化合价不变,但是 H 元素的化合价降低, NH 3 作为氧化剂,故 D 正确;
故选 B 。
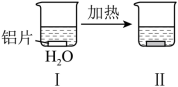
铝片与 Na 2 CO 3 溶液反应的探究实验如下图所示。
| | | |
| 无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡 ( 经检验为 H 2 和 CO 2 ) |
下列说法不正确的是 A . Na 2 CO 3 溶液中存在水解平衡: + H 2 O
+OH -
B .对比 I 、 III ,说明 Na 2 CO 3 溶液能破坏铝表面的保护膜
C .推测出现白色浑浊的原因: +
+H 2 O = Al(OH) 3 ↓+
D .加热后 H 2 和 CO 2 逸出时发生的反应均为氧化还原反应
D
【分析】实验 Ⅰ ,将铝片放入水中,不发生反应;实验 Ⅱ ,给水加热,铝片与热水仍不反应;实验 Ⅲ ,将铝片放入 Na 2 CO 3 溶液中,铝片表面产生细小气泡,表明有少量铝与溶液反应产生 H 2 ;实验 Ⅳ ,加热烧杯,反应剧烈,出现白色浑浊,生成 H 2 和 CO 2 。
【详解】 A . Na 2 CO 3 为强碱弱酸盐,在溶液中发生水解,存在水解平衡: + H 2 O
+OH - , A 正确;
B .在铝片表面,有一层致密的氧化铝保护膜,保护内部的铝,实验 III 中,有气泡产生,则表明铝与溶液发生了反应,对比 I 、 III ,说明 Na 2 CO 3 溶液能破坏铝表面的保护膜, B 正确;
C .推测白色浑浊应为 Al(OH) 3 , Al 、 Al 2 O 3 与碱性溶液反应都能生成 ,
水解生成
,则产生白色浑浊的原因为:
+
+H 2 O = Al(OH) 3 ↓+
, C 正确;
D .加热后 Al 与碱性溶液反应生成 H 2 为氧化还原反应, CO 2 可能是由 NaHCO 3 水解产物受热分解产生,发生的反应为非氧化还原反应, D 不正确;
故选 D 。
本卷还有30题,登录并加入会员即可免费使用哦~

该作品由: 用户菅丹分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。