实验室模拟工业提镁,其相关原理或装置能达到相应实验目的的是
A .制 HCl 气体 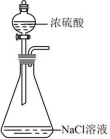 B .干燥 HCl
B .干燥 HCl 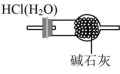
C .制无水
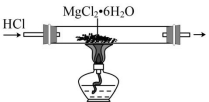 D .电解
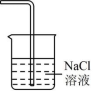
D .电解 尾气处理
C 【详解】 A .制取 HCl 气体时,可以将浓硫酸滴入浓盐酸中,也可以用 NaCl 固体与浓硫酸作用,但用浓硫酸滴入 NaCl 溶液中,不能制得 HCl 气体, A 不正确;
B .碱石灰是 NaOH 与 CaO 的混合物,不仅能吸收水蒸气,还能吸收 HCl , B 不正确;
C .在 HCl 气流中加热 MgCl 2 ∙ 6H 2 O ,可以抑制 MgCl 2 的水解,从而获得纯净的 MgCl 2 , C 正确;
D .电解 MgCl 2 的尾气为 Cl 2 , Cl 2 难溶于饱和 NaCl 溶液,吸收效果差, D 不正确;
故选 C 。
实验发现, 298K 时 1L1mol/L 的 HNO 2 和 HAsO 2 溶液中加 NaOH 固体 ( 忽略温度和溶液体积变化 ) ,溶液 pH 随 lg (X - 表示 NO
或者 AsO
) 变化情况如图所示。已知 HNO 2 和 HAsO 2 均为一元弱酸,且 HNO 2 酸性强于 HAsO 2 。下列说法正确的是

A . I 代表 HAsO 2 , II 代表 HNO 2
B . b 点溶液的 pH=5.3
C . c 点和 d 点对应溶液中 c(Na + ) 相等
D . a 点和 e 点溶液中均有 c(Na + )>c(HX)>c(OH - )>c(H + )
B 【详解】 A .由题干信息可知, HNO 2 酸性强于 HAsO 2 , Ka(HNO 2 )>Ka(HAsO 2 ) ,当横坐标为 0 时, ,即
,
,结合图中数据可知
,
。故 I 代表 HNO 2 , II 代表 HAsO 2 , A 错误;
B . b 点溶液中 ,则有:
,故 b 点对应溶液的 pH=5.3 , B 正确;
C . c 点和 d 点对应溶液均为中性,由于 HNO 2 酸性强于 HAsO 2 ,要使溶液均呈中性, HNO 2 溶液中要加入较多的 NaOH ,即 c 点溶液中 c(Na + ) 大于 d 点溶液, C 错误;
D . a 点溶液 pH=3.3 , , D 错误;
答案选 B 。
常温下,向 某二元弱酸
中滴加稀
溶液,溶液的
、分布系数
[ 已知分布系数
, X 表示为
、
或
] 变化关系如图所示。下列叙述正确的是
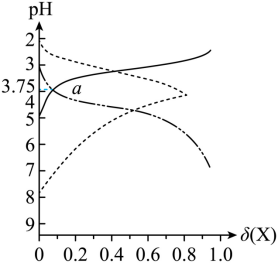
A .图中 a 点处: B .
的数量级为
C . 时,
D .
时,
A 【分析】随 NaOH 溶液加入, c(H 2 A) 减小, c(A 2- ) 增大,而 c(HA - ) 先增大后减小,实线代表 H 2 A ,曲折虚线代表 HA - ,第三条线代表 A 2- ;
【详解】 A .由图可知, a 点 pH=3.75 ,而 lg =lg
,由 pK 2 =4.5 ,可知 K 2 =10 -4.5 ,故 lg
=lg
=lg
=0.75 ,故 A 正确;
B .由 pK 2 =4.5 ,可知 K 2 =10 -4.5 ,故 K h (A 2- )= =10 -9.5 =10 0.5 ×10 -10 , K h (A 2- ) 的数量级为 10 -10 ,故 B 错误;
C . pH=4 时,由图可知, δ(HA - ) > δ(A 2- ) > δ(H 2 A) ,故 c(HA - ) > c(A 2- ) > c(H 2 A) ,故 C 错误;
D . pH=4.5 时, c(OH - ) < c(H + ) ,由图可知, δ(HA - )=δ(A 2- ) ,即 c(HA - )=c(A 2- ) ,根据电荷守恒有 c(Na + )+c(H + )=c(HA - )+2c(A 2- )+c(OH - ) ,则有 c(Na + )=3c(A 2- )+c(OH - )-c(H + ) ,而 c(OH - )-c(H + ) < 0 ,故 c(Na + ) < 3c(A 2- ) ,故 D 错误;
故选: A 。
设 N A 为阿伏加德罗常数的值,下列说法正确的是
A . 60gSiO 2 中的 Si - O 共价键的数目为 2 N A
B . 1molI 中心原子上的价层电子对数目为 2 N A
C . 1mol 苯乙醛分子中含 π 键的数目为 4 N A
D . 25℃ 时, 1L pH =12 的氨水中含有 OH - 数目为 0.01 N A
D 【详解】 A . 60g SiO 2 物质的量为 1mol , 1mol SiO 2 的 Si - O 共价键的数目为 4 N A ,故 A 错误;
B . 以其中一个 I 原子为中心原子, I 中心原子上的价层电子对数目为
,故 1molI
中心原子上的价层电子对数目为 4 N A ,故 B 错误;
C .苯乙醛分子中的苯环含有一个大 π 键,醛基含有一个 π 键,故 1mol 苯乙醛分子中含 π 键的数目为 2 N A ,故 C 错误;
D . 25℃ 时, pH =12 的氨水中 OH - 浓度为 0.01mol/L ,则 1L pH =12 的氨水中含有 OH - 数目为 0.01 N A ,故 D 正确;
故选 D 。
下列离子方程式中,能正确表达反应颜色变化的是
A .向 Mg(OH) 2 浊液中滴加足量 FeCl 3 溶液出现红褐色沉淀: 3Mg(OH) 2 +2Fe 3+ =2Fe(OH) 3 +3Mg 2+
B .将 “84” 消毒液和洁厕灵混用会产生黄绿色气体: ClO - +Cl - +H 2 O=Cl 2 ↑+2OH -
C .将 SO 2 通入溴水中使其褪色: SO 2 + 2H 2 O + Br 2 =2H + + SO + 2HBr
D . Na 2 O 2 在空气中放置后由淡黄色变为白色: 2Na 2 O 2 =2Na 2 O + O 2 ↑
A 【详解】 A .由于 Fe(OH) 3 比 Mg(OH) 2 的溶度积更小,所以向 Mg(OH) 2 浊液中滴加足量 FeCl 3 溶液出现红褐色 Fe(OH) 3 沉淀,离子方程式为: 3Mg(OH) 2 +2Fe 3+ =2Fe(OH) 3 +3Mg 2+ , A 正确;
B . “84” 消毒液的主要成分为 NaClO ,洁厕灵的主要成分为盐酸,二者混用会生成 Cl 2 ,离子方程式为: ClO - +Cl - +2H + =Cl 2 ↑+H 2 O , B 不正确;
C . HBr 为强酸,将 SO 2 通入溴水中使其褪色,离子方程式为: SO 2 + 2H 2 O + Br 2 =4H + + + 2Br - , C 不正确;
D . Na 2 O 2 在空气中放置后,会与空气中的水蒸气和二氧化碳反应,从而由淡黄色变为白色,而不是发生分解反应, D 不正确;
故选 A 。
本卷还有30题,登录并加入会员即可免费使用哦~

该作品由: 用户小笑分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。