某实验团队研究合成氨在不同条件下进行反应,平衡时氨气的含量与起始氢氮比 之间的关系如下图。下列说法正确的是
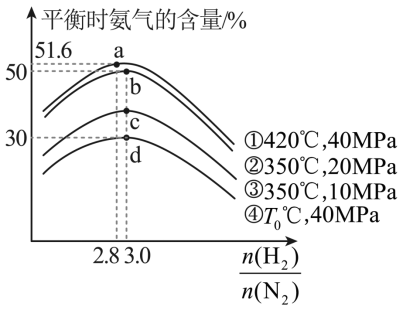
A . <420℃
B . b 点时的转化率:
C . a 、 b 、 c 、 d 四点对应的平衡常数由大到小的顺序为
D .工业合成氨一般以 α- 铁触媒为催化剂, 400~500℃ 下反应,选取该温度的主要原因是氨的平衡产率更高
C
【解析】
【详解】
A .已知合成氨的反应 N 2 +3H 2 2NH 3 是一个放热反应,升高温度,平衡逆向移动, NH 3 的百分含量减小,由曲线 ①④ 可知,
> 420℃ , A 错误;
B .由图可知, b 点时 n(H 2 )/n(N 2 )=3 ,故平衡的转化率: , B 错误;
C .已知合成氨的反应 N 2 +3H 2 2NH 3 是一个放热反应,升高温度,平衡逆向移动,化学平衡常数减小,温度不变,平衡常数不变,由 A 项分析可知, T 0 > 420℃ ,故 a 、 b 、 c 、 d 四点对应的平衡常数由大到小的顺序为
, C 正确;
D .催化剂不能使化学平衡发生移动,故工业合成氨一般以 α- 铁触媒为催化剂, 400~500℃ 下反应,选取该温度的主要原因不是氨的平衡产率更高,而是该温度下催化剂的活性最强, D 错误;
故答案为: C 。
下列关于电解 CuCl 2 溶液 ( 如图所示 ) 的说法中,错误的是
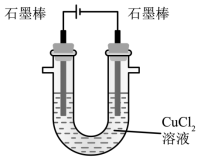
A .电解过程中, Cl — 向阳极移动
B .总反应为: CuCl 2 =Cu 2+ +2Cl —
C .阳极有黄绿色气体产生,并可用湿润的 KI 淀粉试纸检验
D .若将溶液换为硫酸铜溶液,则阴、阳两极得到单质的物质的量之比始终为 2∶1
B
【解析】
【详解】
A .电解过程中,氯离子和氢氧根离子向阳极移动,故 A 正确;
B .氯化铜溶液电解生成铜和氯气,总反应方程式为 CuCl 2 Cu+ Cl 2 ↑ ,故 B 错误;
C .电解过程中,氯离子在阳极失去电子发生氧化反应生成黄绿色的氯气,氯气与碘化钾溶液反应生成的碘使淀粉溶液变蓝色,可用湿润的碘化钾淀粉试纸检验,故 C 正确;
D .若将溶液换为硫酸铜溶液,电解过程中,阴极析出的单质为铜、阳极析出的单质为氧气,硫酸铜溶液完全电解后继续电解,实质上是电解水,阴极析出的单质为氢气、阳极析出的单质为氧气,由得失电子数目守恒可知,铜和氧气的物质的量比与氢气和氧气的物质的量比相等,都是 2∶1 ,故 D 正确;
故选 B 。
某全固态薄膜锂离子电池截面结构如图所示,电极 A 为非晶硅薄膜,充电时 Li + 得电子成为 Li 嵌入该薄膜材料中;电极 B 为 LiCoO 2 薄膜;集流体起导电作用。下列说法正确的是

A .充电时,集流体 A 与外接电源的正极相连
B .放电时,外电路通过 amol 电子时, LiPON 薄膜电解质损失 amolLi +
C .放电时,电极 B 为正极,反应可表示为 Li 1-x CoO 2 +xLi + +xe - =LiCoO 2
D .放电时,电极 A 为负极,反应可表示为 Li x Si-e - =Si+Li +
C
【解析】
【分析】
由题可知,电极 A 为非晶硅薄膜,充电时 Li + 得电子成为 Li 嵌入该薄膜材料中,则电极 A 为阴极,电极反应式为 xLi + +xe - +Si=Li x Si ,电极 B 为阳极,电极反应式为 LiCoO 2 -xe - ═Li 1-x CoO 2 +xLi + ,放电时电极 A 为负极,电极反应为 Li x Si-xe - ═Si+xLi + ,电极 B 为正极,电极反应式为 Li 1-x CoO 2 +xLi + +xe - ═LiCoO 2 ,电池总反应可表示为 Li x Si+Li 1-x CoO 2 Si+LiCoO 2 。
【详解】
A .充电时,电极 A 为阴极,集流体 A 与外接电源的负极相连, A 错误;
B .放电时,外电路通过 amol 电子时,负极生成 amol Li + 进入 LiPOH 薄膜电解质,同时有 amol Li + 从 LiPOH 薄膜电解质流出进入电极 B ,故 LiPOH 薄膜电解质 Li + 数目不变, B 错误;
C .由分析可知,放电时,电极 B 为正极,发生还原反应,电极反应式为 Li 1-x CoO 2 +xLi + +xe - ═LiCoO 2 , C 正确;
D .由分析可知, A 为负极,放电时负极电极反应为 Li x Si-xe - ═Si+xLi + , D 错误;
故答案为: C 。
研究人员利用膜电解技术,以 溶液为主要原料制备
的装置如图所示。已知:在不同 pH 时
和
在溶液中可相互转化,
和
的物质的量浓度的对数与 pH 的关系如图所示。下列叙述正确的是
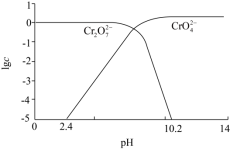

A . a 为负极, b 为正极
B . 在阴极室制得
C .阳极的电极反应式为
D .外电路中每通过 1mol 电子,产生标准状况下 16.8L 气体
D
【解析】
【分析】
根据图像可知,当溶液酸性较强时, 可几乎全部转化为
,故产品室的酸性应该很强,推知产品室为阳极室。
【详解】
A .由分析可知,产品室为阳极室,故 a 为正极, b 为负极,故 A 错误。
B .由分析可知, 在阳极室制得,故 B 错误。
C .由分析可知,阳极的电极反应式为 ,故 C 错误。
D .由分析可知,外电路中通过 1mol 电子时,阳极产生 0.25mol O 2 ,阴极产生 0.5mol H 2 ,故标准状况下产生气体的体积为 16.8L ,故 D 正确。
故答案为: D 。
常温下,将 Cl 2 缓慢通入水中至饱和,然后向所得饱和氯水中滴加 0.1mol·L -1 NaOH 溶液,整个实验进程中溶液的 pH 变化曲线如图所示,下列叙述正确的是
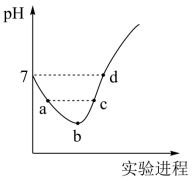
A .向 a 点所示溶液中通入 SO 2 ,溶液的酸性和漂白性均增强
B . b 点所示的溶液中: c(H + )>c(Cl - )>c(HClO)>c(ClO - )>c(OH - )
C . a 点和 c 点溶液中水的电离程度相同
D . d 点所示溶液中: c(Na + )=c(ClO - )+2c(HClO)
B
【解析】
【分析】
将 Cl 2 缓慢通入水中发生反应 ,向右进行的过程,故 a 点是 HCl 和 HClO 的混合溶液,两种酸都会抑制水的电离,从 b 点开始滴加氢氧化钠, c 点时随着 NaOH 溶液的加入,反应生成了 NaCl 和 NaClO ,其中次氯酸根离子会水解,从而促进水的电离,以此解题。
【详解】
A .氯气具有氧化性,能将二氧化硫氧化为硫酸,自身被还原为盐酸,所得到的溶液不再具有漂白性, A 错误;
B . b 点所示溶液中发生反应: Cl 2 +H 2 O H + +Cl - +HClO , HClO 为弱电解质,部分电离,溶液中存在的粒子有: H + 、 Cl - 、 ClO - 、 OH - , H 2 O 、 HClO 、 Cl 2 ,溶液中: c(H + )>c(Cl - )>c(HClO)>c(ClO - )>c(OH - ) , B 正确;
C .由分析可知 a 点时水的电离被抑制,但是在 c 点却存在次氯酸根离子,次氯酸根的水解促进了水的电离, C 错误;
D . d 点溶液呈中性,则 c(H + )=c(OH - ) ,根据电荷守恒得, ,所以
,根据物料守恒得,
,所以
, D 错误;
故选 B 。
本卷还有25题,登录并加入会员即可免费使用哦~

该作品由: 用户小小分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。