下列对实验现象的解释或结论正确的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变黑,体积膨胀,放出有刺激性气味气体 | 浓硫酸具有脱水性和强氧化性,反应中生成 C 、 SO 2 和 CO 2 等 |
| B | 向某溶液中加入盐酸酸化的 BaCl 2 溶液 | 有白色沉淀产生 | 该溶液中一定含有 |
| C | 向苯中滴入少量浓溴水,振荡,静置 | 溶液分层;上层呈橙红色,下层几乎无色, | 苯和溴水发生取代反应,使溴水褪色 |
| D | 向浓度均为 | 出现黑色沉淀 | |
A . A B . B C . C D . D
A
【解析】
【详解】
A .向蔗糖中加入浓硫酸,蔗糖变黑,说明生成 C 单质,浓硫酸具有脱水性,体积膨胀,放出有刺激性气味气体,说明有 和
生成,浓硫酸具有强氧化性,选项 A 正确;
B .向某溶液中加入盐酸酸化的 溶液,有白色沉淀产生,还可能含有
,选项 B 错误;
C .苯和溴水不能发生取代反应,是苯萃取了浓溴水中的 而使溴水褪色,故溶液分层;上层为溴的苯溶液,呈橙红色,下层为水层,几乎无色,选项 C 错误;
D .向浓度均为 和
混合溶液中滴加少量
溶液,出现黑色沉淀,说明
,选项 D 错误。
答案选 A 。
研究电化学腐蚀及防护具有重大意义。铁片在海水中发生腐蚀的模拟装置如图所示,下列有关说法错误的是
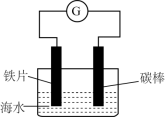
A .铁片作负极,被腐蚀
B .将海水换成蒸馏水,铁片腐蚀速率减慢
C .碳棒上发生的电极反应为
D .将碳棒换成锌片,铁片不易被腐蚀
C
【解析】
【分析】
根据图中信息可知,装置为原电池,铁片为负极,碳棒为正极,据此分析解题。
【详解】
A .铁片作负极,被腐蚀, A 正确;
B .将海水换成蒸馏水不含电解质,铁片腐蚀速率减慢, B 正确;
C .海水为中性,碳棒上发生吸氧腐蚀,电极反应为 , C 错误;
D .将碳棒换成锌片,铁片不易被腐蚀,锌片比铁活泼,锌片做负极, D 正确;
答案选 C 。
用黄铜灰渣 ( 含有 Cu 、 Zn 、 CuO 、 ZnO 及少量 FeO 、 Fe 2 O 3 ) 生产晶体 Cu(NO 3 ) 2 ·3H 2 O 的流程如图所示,下列说法正确的是
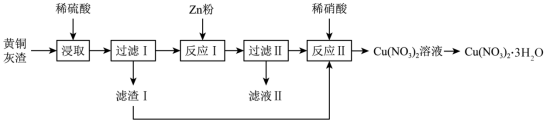
A . “ 浸取 ” 时使用浓硫酸可加快反应速率
B .滤液 II 中一定含 Zn 2+ 、 Fe 2+ 、 SO 离子
C .若制得纯度较高的 Cu(NO 3 ) 2 ·3H 2 O ,反应中所加 Zn 需过量
D .将 Cu(NO 3 ) 2 溶液蒸发浓缩、冷却结晶、过滤得到 Cu(NO 3 ) 2 ·3H 2 O
B
【解析】
【分析】
黄铜灰渣含有 Cu 、 Zn 、 CuO 、 ZnO 及少量 FeO 、 Fe 2 O 3 ,加入稀硫酸, Cu 不溶于稀硫酸,滤渣 Ⅰ 是 Cu ; Zn 、 CuO 、 ZnO 、 FeO 、 Fe 2 O 3 和硫酸反应生成 Zn 2+ 、 Cu 2+ 、 Fe 2+ 、 Fe 3+ ,铜把少量的 Fe 3+ 还原为 Fe 2+ ,加入适量的锌粉,把 Cu 2+ 还原为 Cu ,铜和稀硝酸反应生成硝酸铜溶液,蒸发浓缩、冷却到 30℃ 以上结晶、过滤得到 Cu(NO 3 ) 2 ·3H 2 O 。
【详解】
A .浓硫酸中氢离子浓度小, “ 浸取 ” 时使用浓硫酸不能加快反应速率,故 A 错误;
B .加入适量的锌粉,把 Cu 2+ 还原为 Cu ,所以滤液 II 中一定含 Zn 2+ 、 Fe 2+ 、 SO 离子,故 B 正确;
C .若反应 Ⅰ 中加入过量的 Zn ,得到的固体中 Cu 中含有 Zn 、 Fe 杂质,产品 Cu(NO 3 ) 2 ·3H 2 O 中含有硝酸锌、硝酸铁,故 C 错误;
D . Cu 2+ 会水解,故在蒸发 Cu(NO 3 ) 2 溶液时,要加硝酸抑制 Cu 2+ 水解,再冷却结晶,故 D 错误;
选 B 。
以 CO 和 H 2 为原料合成甲醇是工业上的成熟方法,直接以 CO 2 为原料生产甲醇是目前的研究热点。我国科学家用 CO 2 人工合成淀粉时,第一步就需要将 CO 2 转化为甲醇。
已知: ①CO(g)+2H 2 (g) CH 3 OH(g) ΔH 1 =-90.5kJ•mol -1
②CO(g)+H 2 O(g) CO 2 (g)+H 2 (g) ΔH 2 =-41.1kJ•mol -1
③2H 2 (g)+O 2 (g)=2H 2 O(g) ΔH 3 =-483.6kJ•mol -1
下列说法 不正确 的是
A .若温度不变,反应 ① 中生成 1mol CH 3 OH(l) 时,放出的热量大于 90.5kJ
B . CO 2 与 H 2 合成甲醇的热化学方程式为: CO 2 (g)+3H 2 (g) CH 3 OH(g)+H 2 O(g) ΔH=-49.4kJ•mol -1
C .通过电解制 H 2 和选用高效催化剂,可降低 CO 2 与 H 2 合成甲醇的反应的焓变
D .以 CO 2 和 H 2 O 为原料合成甲醇,同时生成 O 2 ,该反应需要吸收能量
C
【解析】
【详解】
A . 1molCH 3 OH ( g )能量高于 1molCH 3 OH ( l ),反应物的总能量相同,根据能量守恒定律,若温度不变,反应 ① 中生成 1molCH 3 OH ( l )时,放出的热量大于 90.5kJ ,故 A 正确;
B .根据盖斯定律 ①-② 得反应 ④CO 2 (g)+3H 2 (g) CH 3 OH(g)+H 2 O(g)ΔH= ( -90.5+41.1 ) kJ•mol -1 =-49.4kJ•mol -1 ,故 B 正确;
C .催化剂可降低 CO 2 与 H 2 合成甲醇的反应的活化能,但不改变反应的焓变,故 C 错误;
D .根据盖斯定律 ④×2-③×3 得 2CO 2 (g)+4H 2 O(g) 2CH 3 OH(g)+3O 2 (g) ΔH= ( -49.4×2+483.6×3 ) kJ/mol=+1352kJ/mol > 0 ,则该反应需要吸收能量,故 D 正确;
故选 C 。
下列有关说法正确的是
A .化学平衡发生移动,平衡常数必发生变化
B .加入催化剂,单位体积内反应物分子中活化分子百分数不变
C .合成氨时将氨液化分离,可提高原料的利用率,可以用勒夏特列原理解释
D .恒温恒容容器中, N 2 (g)+3H 2 (g) 2NH 3 (g) 达平衡后,改变条件使平衡正向移动,再达平衡时 NH 3 的体积分数一定增大
C
【解析】
【详解】
A .改变浓度、压强时,平衡移动,平衡常数不变;只有改变温度,平衡常数才发生改变,故 A 错误;
B .加入催化剂,活化能降低,单位体积内反应物分子中活化分子百分数增大,故 B 错误;
C .合成氨时将氨液化分离,平衡正向移动,可提高原料的利用率,可以用勒夏特列原理解释,故 C 正确;
D .恒温恒容容器中, N 2 (g)+3H 2 (g) 2NH 3 (g) 达平衡后,再通入氮气,平衡正向移动,再达平衡时 NH 3 的体积分数可能降低,故 D 错误;
选 C 。
本卷还有48题,登录并加入会员即可免费使用哦~

该作品由: 用户周建国分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。