2010 年诺贝尔化学奖授予理查德 · 赫克等三位科学家,以表彰他们在 “ 钯催化交叉偶联 ” 方面的研究。下面关于催化剂的说法正确的是
A . 催化剂不能改变反应物的转化率
B . 催化剂通过升高反应的活化能来加快反应速率
C . 催化剂能够改变反应的反应热
D . 催化剂只改变反应的正反应速率
A
【详解】
A .催化剂能够降低反应的活化能,使更多的普通分子变为活化分子,活化分子数增加,有效碰撞次数增加,反应速率加快;但由于对正、逆反应速率影响相同,因此不能使化学平衡发生移动,因此不能改变反应物的转化率, A 正确;
B .催化剂能够降低反应的活化能,使更多的普通分子变为活化分子,活化分子数增加,有效碰撞次数增加,反应速率加快, B 错误;
C .使用催化剂只能降低反应的活化能,但不能改变反应物、生成物的总能量,因此它不能改变反应的反应热, C 错误;
D .催化剂能够降低反应的活化能,使正、逆反应速率加快,且对正、逆反应速率影响相同, D 错误;
故合理选项是 A 。
已知: 与
反应的
;
与
反应的
。则
在水溶液中电离的
等于
A . B .
C . D .
C
【分析】
主要考查关于 △ H 的计算和对盖斯定律的迁移应用。
【详解】
HCN(aq) 、 HCl(aq) 分别与 NaOH(aq) 反应 △H 的差值即为 HCN 在溶液中电离的能量, HCN 属于弱电解质,其电离过程要吸收,即 △H > 0 ,综合以上分析,可知 △H =+43.5kJ·mol -1 ,
答案为 C 。
对于某一可逆反应,在不同条件下的平衡状态中,正、逆反应速率的关系是 ( )
A . 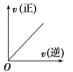 B .
B . 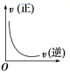 C .
C . 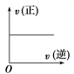 D .
D . 
A
【详解】
对于某一可逆反应,在不同条件下的平衡状态中,正、逆反应速率一定相等,即 υ (正) =υ (逆),
A .该图象中正逆反应速率始终相等,表示的是在不同条件下的平衡状态,选项 A 正确;
B .该图象中,只有某一时刻才能满足 υ (正) =υ (逆),不能表示在不同条件下的平衡状态,选项 B 不正确;
C .该图象中,逆反应速率增大,正反应速率不变, υ (正) =υ (逆)不始终成立,不能表示在不同条件下的平衡状态,选项 C 不正确;
D .根据图象中曲线变化可知,正逆反应速率不满足始终相等,不能表示在不同条件下的平衡状态,选项 D 不正确;
答案选 A 。
【点睛】
本题考查了化学反应速率与化学平衡状态的图象,题目难度不大,注意掌握化学平衡状态的本质,明确处于平衡状态的可逆反应中,一定满足正逆反应速率相等。
充分燃烧一定量的丁烷气体放出的热量为 Q 。完全吸收它生成的 气体生成酸式盐,需
的
溶液
,则丁烷的燃烧热为
A . B .
C .
D .
B
【详解】
燃烧热是在 101kPa 下, 1mol 纯物质完全燃烧生成指定产物时放出的热量。 1molC 4 H 10 完全燃烧生成 4molCO 2 , CO 2 和 NaOH 溶液反应生成酸式盐 NaHCO 3 : CO 2 +NaOH=NaHCO 3 ,所以有 ,则丁烷的物质的量
,所以丁烷的燃烧热为
. ,故答案为 B 。
反应 2A(g) 2Y(g) + E(g)ΔH>0 达到平衡时,要使正反应速率降低, A 的浓度增大,应采取的措施是( )
A . 加压 B . 减压 C . 减小 E 的浓度 D . 降温
D
【分析】
达平衡时,要使 v 正 降低,可采取降低温度、减小压强或减小浓度的措施,使 c ( A )增大,应使平衡向逆反应方向移动,据此结合选项分析解答。
【详解】
A 、增大压强,平衡向逆反应方向移动, A 的浓度增大,但正、逆反应速率都增大,故 A 错误;
B 、降低压强,正、逆速率都减小,平衡向正反应方向移动, A 的浓度降低,故 B 错误;
C 、减小 E 的浓度,平衡向正向反应方向移动, A 的浓度减小,正逆反应速率减小,故 C 错误;
D 、正反应为吸热反应,降低温度,平衡逆反应方向移动,正、逆反应速率都减小, A 的浓度增大,故 D 正确。
故选 D 。
本卷还有21题,登录并加入会员即可免费使用哦~

该作品由: 用户张阳分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。