新材料问世常常带动新科技、新技术的应用和发展,下列有关说法不正确的
A . 中国的航空铝材处于世界领先的行列,该铝材是纯度很高的铝,密度小,强度高
B . 稀土元素被称为 “ 冶金工业的维生素 ” ,其加入钢中后可增加钢的韧性、抗氧化性
C . “神舟”六号载人飞船表面覆盖某种特殊材料,这种材料强度高,耐高温
D . 2017 年 8 月我国宣布成功完成了某超级钢的研制,超级钢从组成看上是混合物
A
【详解】
A .中国的航空铝材处于世界领先的行列,该铝材是一种铝合金,铝合金的密度小,强度高,故 A 错误;
B .稀土元素被称为 “ 冶金工业的维生素 ” ,在钢中加入铬、镍等元素后可制成不锈钢,增加钢的韧性和抗氧化性,故 B 正确;
C . “神舟”六号载人飞船表面覆盖某种特殊材料,这种材料是为了防止飞船与大气摩擦时产生高温而起火燃烧,所以飞船表面的材料应符合强度高、耐高温、密度小、耐腐蚀等优异性能,故 C 正确;
D . 2017 年 8 月我国宣布成功完成了某超级钢的研制,超级钢是通过各种工艺方法将普通的碳素结构钢的铁素体晶粒细化,进而使其强度有大幅度提高的钢材,超级钢主要是由铁、碳等元素构成的合金,合金从组成看上是混合物,故 D 正确;
答案选 A 。
NaCl 是我们生活中必不可少的物质。将 NaCl 固体溶于水,溶解过程如图所示,下列说法正确的是
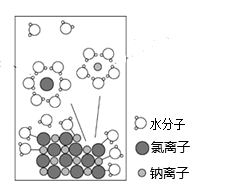
A . 该过程发生了分解反应
B . 水若足量, Na + 和 Cl - 也不会完全成为水合离子状态
C . 水合 Na + 的图示不科学
D . NaCl 溶于水后发生了电离,是在通电条件下进行的
C
【详解】
A .该过程只有化学键的断裂,并没有新化学键的形成,不属于化学变化,更不是分解反应,故 A 错误;
B . NaCl 是强电解质,在水中可以完全电离,水若足量, Na + 和 Cl - 可以完全成为水合离子状态,故 B 错误;
C .钠离子带正电荷,形成水合离子时应该是水中带负电的氧原子靠近钠离子,正确的图示为  ,故 C 正确;
,故 C 正确;
D . NaCl 溶于水后在水分子的作用下离子键断裂,形成水合离子,并不需要通电,故 D 错误;
答案为 C 。
磁流体是电子材料的新秀。在一定条件下,将含等物质的量的 FeSO 4 和 Fe 2 (SO 4 ) 3 的溶液混合,再滴入稍过量的 NaOH 溶液,可得到分散质粒子大小在 36 - 55nm 之间的黑色磁流体。下列说法中正确的
A . 所得的分散系属于悬浊液
B . 用一束光照射该分散系能产生丁达尔效应
C . 所得的分散系中分散质为 Fe 2 O 3 ,不能透过滤纸
D . 分散系为胶体,分散质粒子大小即 Fe(OH) 3 分子直径大小
B
【分析】
根据题意可知,磁流体分散系分散质粒子直径在 36-55nm ,属于胶体的范畴,具备胶体的性质。
【详解】
A .分散质粒子直径在 36-55nm 之间,所得分散系为胶体,不是悬浊液,故 A 错误;
B .该分散系属于胶体,胶体有丁达尔效应,所以当一束光照射该分散系时会出现光亮的通路,故 B 正确;
C .分散质是黑色的,而 Fe 2 O 3 是红棕色的,则分散质不是 Fe 2 O 3 ,且胶体可以透过滤纸,故 C 错误;
D .该胶体分散质是黑色的,氢氧化铁胶体为红褐色,而且胶粒为很多分子的集合体,不是一个分子,故 D 错误;
答案选 B 。
下列说法正确的是
A . 和
互为同位素 B . 质子数为 6 ,中子数为 8 的微粒:
C . NaClO 的电子式: ![]() D .
D . 结构式:
C
【详解】
A .质子数相同,中子数不同的同一元素的不同原子互称同位素,同位素的研究对象是原子, 和
都是氧元素组成的不同单质,互为同素异形体,故 A 不符合题意;
B .元素符号左下角的数字代表质子数,左上角的数字代表质量数,质子数为 6 ,中子数为 8 的碳原子的质量数为 6+8=14 ,微粒表示为: ,故 B 不符合题意;
C . NaClO 中钠离子和次氯酸根离子间形成离子键,次氯酸根中氧原子在中间,得到钠原子给一个电子,和氯原子共用一对共用电子对, NaClO 的电子式 ![]() ,故 C 符合题意;
,故 C 符合题意;
D .碳原子的最外层电子数为 4 ,氧原子的最外层电子数为 6 ,要达到稳定结构, 中碳原子和两个氧原子分别形成两对共价键,结构式: O=C=O ,故 D 不符合题意;
答案选 C 。
四氧化三铁 (Fe 3 O 4 ) 磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备 Fe 3 O 4 纳米颗粒的反应是 。下列问题叙述不正确的是
A . 水热法制备 Fe 3 O 4 纳米颗粒的反应中,还原剂就是
B . 离子方程式中 x =4
C . 每生成 1 mol Fe 3 O 4 ,反应转移的电子为 4mol
D . 该条件下 O 2 氧化性强于
A
【详解】
A .根据反应方程式可知,硫元素化合价由 +2 价变为 +2.5 价,硫元素化合价升高;且铁元素化合价也生,故该反应的还原剂是: 、
, A 错误;
B .根据电荷守恒与质量守恒定律可知, x =4 , B 正确;
C .每生成 1 mol Fe 3 O 4 的同时生成 1 mol ,故该反应转移的电子为
,故每生成 1 mol Fe 3 O 4 ,反应转移的电子为 4 mol , C 正确;
D .氧元素化合价降低,氧气是氧化剂, 是氧化产物,故该条件下 O 2 氧化性强于
, D 正确;
答案选 A 。
本卷还有19题,登录并加入会员即可免费使用哦~

该作品由: 用户蒋晓雨分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。