2019安徽高一下学期人教版(2019)高中化学期末考试135082
高中
整体难度:中等
2019-08-13
题号
一
二
三
四
五
评分
一、选择题 (共18题)
添加该题型下试题
1.
硒(Se)是人体必需的微量元素,具有抗氧化、增强免疫力等作用,下列说法错误的是( )
A. ![]() 与
与![]() 互为同位素 B.
互为同位素 B. ![]() 与
与![]() 属于同种原子
属于同种原子
C. ![]() 与
与![]() 核外电子排布相同 D.
核外电子排布相同 D. ![]() 与
与![]() 是硒元素的两种不同核素
是硒元素的两种不同核素
难度:
知识点:原子结构
使用次数:152
【答案】
B
2.
下列含有共价键的离子化合物是( )
A. Al2O3 B. NH3·H2O C. CH3COONa D. Na2O
难度:
知识点:化学键
使用次数:197
【答案】
C
3.
下列属于吸热反应的是( )
A. 氧化钙与水反应 B. 铁丝在氧气中燃
C.NaOH溶液与盐酸反应 D. Ba(OH)2·8H2O晶体与NH4Cl晶体反应
难度:
知识点:化学反应中的能量变化
使用次数:196
【答案】
D
4.
下图是土豆电池的示意图。土豆电池工作时,下列有关说法正确的是( )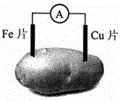
A. Fe作负极,电极反应式为: Fe-3e-=Fe3+ B. Cu作正极,Cu片质量减少
C. 电子由Fe经导线流向Cu片 D. 实现了电能向化学能的转化
难度:
知识点:电化学 胶体
使用次数:128
【答案】
C
5.
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A. 铅蓄电池放电时,负极反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O
B. 粗铜精炼时,与电源负极相连的是纯铜,阴极反应式为Cu2++2e-=Cu
C. 生铁中含碳,抗腐蚀能力比纯铁强
D. 铁制品上镀锌,锌做阴极,铁制品做阳极,电解质溶液中含Zn2+
难度:
知识点:电化学 胶体
使用次数:195
【答案】
B
本卷还有17题,登录并加入会员即可免费使用哦~
立即下载
全选试题
编辑试卷
收藏试卷

试题总数:
22
总体难度:
中等
难度统计
难度系数
数量
占比
容易
4
18.18%
中等
15
68.18%
偏难
3
13.63%
题型统计
大题类型
数量
占比
选择题
18
81.81%
填空题
2
9.09%
综合题
2
9.09%
知识点统计
知识点
数量
占比
原子结构
1
4.54%
化学键
1
4.54%
化学反应中的能量变化
1
4.54%
电化学 胶体
4
18.18%
离子反应
1
4.54%
沉淀溶解平衡
2
9.09%
电离平衡 水解平衡
2
9.09%
化学平衡
1
4.54%
化学平衡单元测试
2
9.09%
化学的反应中的物质变化和能量变化单元测试
1
4.54%
电离平衡单元测试
2
9.09%
水的电离和溶液的PH
1
4.54%
氧化还原反应
1
4.54%
物质结构 元素周期律
1
4.54%
化学反应速率 化学平衡
1
4.54%
版权提示
该作品由: 用户李明凡分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。