能源是现代文明的原动力,化学电池在生产生活中有着广泛的应用。
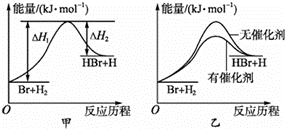
(1) 根据构成原电池的本质判断,下列反应可以设计成原电池的是 ___________( 填序号 ) 。
A . C(s)+H 2 O(g) =CO(g)+H 2 (g)
B . NaOH(aq)+HCl(aq) =NaCl(aq)+H 2 O(l)
C . 2CO(g)+O 2 =2CO 2 (l)
(2) 为了探究化学反应中的能量变化,某同学设计了如图所示两个实验。有关实验现象,下列说法正确的是 ___________( 填序号 ) 。
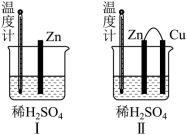
A .图 I 和图 II 的气泡均产生于锌棒表面
B .图 II 中产生气体的速率比图 I 快
C .图 I 中温度计的示数高于图 II 的示数
D .图 I 和图 II 中温度计的示数相等,且均高于室温
(3) 图 II 中外电路中的电子是从 ___________( 填 “Zn” 或 “Cu”) 电极经导线流向 ___________ 电极, H + 向 ________( 填 “Zn” 或 “Cu”) 移动。若反应过程中有 0.2 mol 电子发生转移,则生成的氢气在标准状况下的体积为 ___________ 。若电池的总反应为 2Fe 3+ +Cu=2Fe 2+ +Cu 2+ ,则负极材料是 ___________( 填化学式 ) 。
(4) 知识源于实践。学习原电池知识后,某学习小组以 Zn 和 Cu 为电极材料,制作了如图所示的水果电池 ( 水果果汁中含游离的 H + ) 。该组电池放电时,下列说法正确的是 ___________( 填序号 ) 。

A .每个水果果汁中的 H + 移向正极
B .锌 a 、 b 发生的电极反应式为 2H + +2e - =H 2 ↑
C .四个水果电池串联,则电极 d 为铜片
D .铜 a 为电池正极,发生氧化反应
答案
(1)C
(2)BC
(3) Zn Cu Cu 2.24 L Cu
(4)A
【解析】( 1 )
原电池发生的是自发的氧化还原反应;
A . C(s)+H 2 O(g) =CO(g)+H 2 (g) 为氧化还原反应,但为吸热反应,不能设计为原电池,选项 A 错误;
B . NaOH(aq)+HCl(aq) =NaCl(aq)+H 2 O(l) 是复分解反应,不是氧化还原反应,选项 B 错误;
C . 2CO(g)+O 2 =2CO 2 (l) ,该反应为氧化还原反应,且为放热反应,能设计为原电池,故 C 正确;
故答案为: C ;
( 2 )
A .图 ⅠZn 与稀硫酸反应, Zn 表面产生气泡;图 Ⅱ 形成原电池, Cu 作正极,电极反应为 2H + +2e - =H 2 ↑ , Cu 表面产生气泡,选项 A 错误;
B .图 Ⅱ 中形成原电池,产生气体的速率比图 I 快,选项 B 正确;
C .图 Ⅱ 形成原电池,化学能主要转化为电能,散失热量少,故图 Ⅰ 中温度计的示数高于图 Ⅱ 的示数,选项 C 正确;
D .图 Ⅰ 和图 Ⅱ 中发生反应均有热量产生,图 Ⅰ 产生热量更多,图 Ⅰ 中温度计的示数高于图 Ⅱ 的示数,且均高于室温,选项 D 错误;
答案选 BC ;
( 3 )
图 II 中形成原电池,锌为负极铜为正极,外电路中的电子是从 Zn 电极经导线流向 Cu 电极,阳离子移动到正极,则 H + 向 Cu 移动。若反应过程中有 0.2 mol 电子发生转移,根据电极反应 2 H + +2e - =H 2 ↑ ,则生成的氢气在标准状况下的体积为 2.24 L ;若电池的总反应为 2Fe 3+ +Cu=2Fe 2+ +Cu 2+ ,则负极材料是 Cu ;
( 4 )
A .阳离子向正极移动,故每个水果果汁中的 Ht 移向正极,选项 A 正确;
B . Zn 为负极,失电子发生氧化反应,选项 B 错误;
C .四个水果电池串联,可知正极连接负极,负极连接正极,则 d 为 Zn ,做负极,选项 C 错误;
D .结合分析可知,铜 a 为电池正极,发生还原反应,选项 D 错误;
答案选 A 。