根据要求回答下列问题:
反应 的能量变化趋势如图所示。
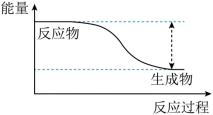
(1) 该反应为 ___________( 填 “ 吸热 ” 或 “ 放热 ”) 反应。
(2) 若要使该反应的反应速率加快,下列措施不可行的是 ___________( 填字母 ) 。
A .将铁片改为铁粉
B .滴加少量 溶液
C .升高温度
D .将稀硫酸改为 98% 的浓硫酸
(3) 欲区分葡萄糖和淀粉,可选用 ___________( 填字母,下同 ) 。
A .碘水 B .银氨溶液 C .盐酸 D . 溶液
(4) 氮的化合物常用作制冷剂的是 ___________( 填名称 ) ,向蔗糖中滴加少量浓硫酸并搅拌,出现 “ 黑色面包 ” ,并产生刺激性无色气体,这一现象显示浓硫酸的 ___________( 填性质 ) 。
(5) 燃煤排放的尾气中含有二氧化硫、氮的氧化物 ( 主要为 ) 等污染物,工业上采用
碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。脱硫的离子方程式为 ___________ ,实验证明相对于
,
更难脱除,其原因可能是 ___________ 。
答案
(1) 放热
(2)D
(3)B
(4) 液氨 脱水性、强氧化性
(5) 2OH - +ClO - +SO 2 = +Cl - +H 2 O 相同条件 下 SO 2 在水溶液中溶解性大于 NO
【解析】( 1 )
从图可知,反应物总能量高于生成物总能量,所以该反应为放热反应,故答案为:放热;
( 2 )
A 、改铁片为铁粉,增大了接触面积,反应速率增大,故 A 不选;
B 、滴加少量 溶液与 Fe 反应生成 Cu ,形成原电池,加快反应速率,故 B 不选;
C 、升高温度,反应速率增大,故 C 不选;
D 、反应物为铁和硫酸反应,改稀硫酸为 98% 的浓硫酸,发生钝化现象,不产生氢气,故 D 选;故答案为: D ;
( 3 )
葡萄糖为还原性糖,可与弱氧化剂发生反应,淀粉不能,用银氨溶液可以鉴别葡萄糖与淀粉,故选: B ;
( 4 )
氨气极易溶于水,氨气易液化,液氨汽化需要吸收大量的热,具有制冷作用,常用作制冷剂,化学式 NH 3 ;浓硫酸具有脱水性、强氧化性,蔗糖碳化后,与浓硫酸发生氧化还原反应,故答案为:液氨;脱水性、强氧化性;
( 5 )
碱性条件下, NaClO 溶液与二氧化硫反应生成硫酸根离子和氯离子,离子方程式为 2OH - +ClO - +SO 2 = +Cl - +H 2 O ,实验证明相对于 SO 2 , NO 更难脱除,其原因可能是相同条件 下 SO 2 在水溶液中溶解性大于 NO ,故答案为: 2OH - +ClO - +SO 2 =
+Cl - +H 2 O ;相同条件 下 SO 2 在水溶液中溶解性大于 NO 。



 B
B
 D
D