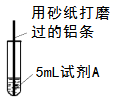
研究小组进行如图所示实验,试剂 A 为 0.2mol·L -1 CuSO 4 溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和 CuSO 4 溶液、 CuCl 2 溶液反应的影响因素。用不同的试剂 A 进行实验 1~ 实验 4 ,并记录实验现象:
| 实验序号 | 试剂 A | 实验现象 |
| 1 | 0.2mol·L -1 CuCl 2 溶液 | 铝条表面有气泡产生,并有红色固体析出 |
| 2 | 0.2mol·L -1 CuSO 4 溶液,再加入一定质量的 NaCl 固体 | 开始铝条表面无明显变化,加 NaCl 后,铝条表面有气泡产生,并有红色固体析出 |
| 3 | 2mol·L -1 CuSO 4 溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
| 4 | 2mol·L -1 CuCl 2 溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
( 1 ) 实验 1 中,铝条表面析出红色固体的反应的离子方程式为 ___________ 。
( 2 ) 实验 2 的目的是证明铜盐中的阴离子 Cl — 是导致实验 1 中反应迅速发生的原因,实验 2 中加入 NaCl 固体的质量为 ___________ g(NaCl 的相对分子质量 58.5) 。
( 3 ) 实验 3 的目的是 ___________ 。
( 4 ) 经检验知,实验 4 中白色固体为 CuCl ,甲同学认为产生白色固体的原因可能是发生了 Cu+CuCl 2 =2CuCl 。
查阅资料知: CuCl 难溶于水,能溶解在 Cl — 浓度较大的溶液中,生成 [CuCl 2 ] — 络离子,用水稀释含 [CuCl 2 ] — 的溶液时会重新析出 CuCl 白色沉淀。
为探究实验 4 中溶液呈现棕褐色的原因,分别取白色 CuCl 固体进行以下实验:
| 实验序号 | 实验操作 | 实验现象 |
| i | 加入浓 NaCl 溶液 | 沉淀溶解,形成无色溶液 |
| ii | 加入饱和 AlCl 3 溶液 | 沉淀溶解,形成褐色溶液 |
| iii | 向 i 所得溶液中加入 2mol·L -1 CuCl 2 溶液 | 溶液由无色变为褐色 |
①由上述实验及资料可推断,实验 4 中溶液呈棕褐色的原因可能是 [CuCl 2 ] — 与 Al 3+ 、 ___________ 作用的结果。
②为确证实验 4 所得的棕褐色溶液中含有 [CuCl 2 ] — ,应补充的实验是:取适量实验 4 的棕褐色溶液, ___________ 。
( 5 ) 上述实验说明,铝和 CuSO 4 溶液、 CuCl 2 溶液的反应现象与 ______ 、 ______ 有关。
答案
( 1 ) 3Cu 2+ +2Al=3Cu+2 Al 3+
( 2 ) 0.117
( 3 ) 证明增大 CuSO 4 溶液浓度能够使 Al 和 CuSO 4 溶液反应
( 4 ) Cu 2+ 加水稀释,观察是否出现白色沉淀
( 5 ) 铜盐中阴离子的种类 铜盐溶液的浓度
【分析】
该实验的目的是探究铝和 CuSO 4 溶液、 CuCl 2 溶液反应的影响因素,证明铝和 CuSO 4 溶液、 CuCl 2 溶液的反应现象与铜盐中阴离子的种类、铜盐溶液的浓度等有关。
( 1 )
实验 1 中,铝条表面析出红色固体的反应为铝和氯化铜溶液反应生成铜和氯化铝,反应的离子方程式为 3Cu 2+ +2Al=3Cu+2 Al 3+ ,故答案为: 3Cu 2+ +2Al=3Cu+2 Al 3+ ;
( 2 )
实验 1 中氯化铜溶液中氯离子的物质的量为 0.2mol/L × 0.005L × 2=0.002mol ,由实验 2 的目的是证明铜盐中的阴离子 Cl — 是导致实验 1 中反应迅速发生的原因可知,实验 2 中溶液中氯离子的物质的量与实验 1 相等,则氯化钠的质量为 0.002mol × 58.5g/mol=0.117g ,故答案为: 0.117 ;
( 3 )
与实验 2 相比,实验 3 增大了硫酸铜溶液的浓度,由铝条表面有少量气泡产生,并有少量红色固体可知,增大了硫酸铜溶液的浓度,可以使铝和硫酸铜溶液反应,故答案为:证明增大 CuSO 4 溶液浓度能够使 Al 和 CuSO 4 溶液反应;
( 4 )
① 由上述实验及资料可推断,实验 4 中溶液呈棕褐色的原因可能是溶液中二氯合铜离子与铝离子、铜离子作用的结果,故答案为: Cu 2+ ;
② 由题给信息可知,取适量实验 4 的棕褐色溶液加水稀释,观察是否出现白色沉淀可以确证实验 4 所得的棕褐色溶液中含有二氯合铜离子,故答案为:加水稀释,观察是否出现白色沉淀;
( 5 )
根据实验 1 和 2 、 2 和 3 、 1 和 4 中所用试剂的种类和浓度以及实验现象可知,铝和硫酸铜溶液、氯化铜溶液的反应现象与铜盐中阴离子的种类、铜盐溶液的浓度因素有关,故答案为:铜盐中阴离子的种类;铜盐溶液的浓度。

 (纯氧中发出耀眼的白光)
(纯氧中发出耀眼的白光) (Al2S3在溶液中完全双水解)
(Al2S3在溶液中完全双水解)
 (AlN与水反应生成Al(OH)3和NH3↑)
(AlN与水反应生成Al(OH)3和NH3↑) 




 ,
, ,所以根据得失电子守恒可知:
,所以根据得失电子守恒可知: ,利用此关系可以方便地进行有关计算。
,利用此关系可以方便地进行有关计算。