SF 6 可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关 SF 6 的说法正确的是
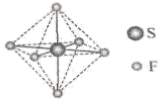
A . 是非极性分子 B . 键角 都等于 90°
C . 与
之间共用电子对偏向 S D .
原子满足 8 电子稳定结构
答案
A
【详解】
A .结构对称、正负电荷重心重合的分子为非极性分子, SF 6 分子呈正八面体结构, S 原子位于正八面体的中心,该分子结构对称、正负电荷重心重合,所以为非极性分子, A 正确;
B . SF 6 是结构对称、正负电荷重心重合的分子,故键角 不都等于 90° , B 错误;
C .由于 F 的电负性比 S 的大, S 与 F 之间共用电子对偏向 F , C 错误;
D .中心元素价电子数 + 化合价的绝对值 =8 时该分子中所有原子都达到 8 电子稳定结构,但氢化物除外,该化合物中 S 元素化合价 + 价电子数 =6+6=12 ,则 S 原子不是 8 电子稳定结构, D 错误;
故答案为: A 。


 等。
等。  、金刚石等。
、金刚石等。  等。
等。  等。
等。  等。
等。  等。
等。  等。
等。  等原子晶体。
等原子晶体。  等)。
等)。