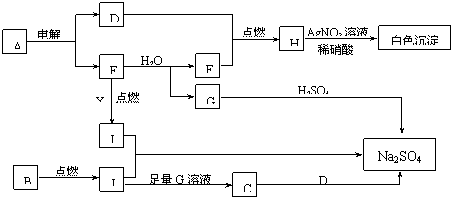
如图是研究二氧化硫性质的微型实验装置。现用 60% 硫酸溶液和亚硫酸钠晶体反应制取 SO 2 气体,实验现象很明显,且不易污染空气。下列说法中错误的是( )
A . 紫色石蕊溶液变蓝色
B . 品红溶液褪色
C . 溴水橙色褪去
D . 含酚酞的 NaOH 溶液红色变浅或褪色
答案
A
【分析】
SO 2 有漂白性、还原性、酸性。
【详解】
A .酸性气体能使紫色石蕊溶液变红色, A 错误;
B . SO 2 有漂白性,能使品红溶液褪色, B 正确;
C . SO 2 有还原性,能还原溴水, C 正确;
D . SO 2 与 NaOH 溶液反应, D 正确;
答案选 A 。
【点睛】
SO 2 能使溴水褪色,体现还原性,不是漂白性。


 2SO3
2SO3





 无色溶液
无色溶液 恢复原色。
恢复原色。


 ,如下数轴所示:
,如下数轴所示:
 则固体物质为Na2SO3,
则固体物质为Na2SO3, ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3. ,则同体物质为NaHSO3
,则同体物质为NaHSO3 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3, ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。