已知 X 、 Y 、 Z 是阳离子, K 是阴离子, M 、 N 是分子。它们都由短周期元素组成,且具有以下结构特征和性质:
①它们的核外电子总数都相同;
② N 溶于 M 中,滴入酚酞,溶液变红;
③ Y 和 K 都由 A.B 两元素组成, Y 核内质子数比 K 多 2 个;
④ X 和 N 都由 A 、 C 两元素组成, X 和 Y 核内质子总数相等;
⑤ X 和 K 的浓溶液在加热条件下生成 M 和 N ;
⑥ Z 为单核离子,向含有 Z 的溶液中加入少量含 K 的溶液,有白色沉淀生成,再加入过量的含 K 或 Y 的溶液,沉淀消失。
回答下列问题:
(1)Y 的化学式为 _______ ; X 的电子式为 _______
(2) 试比较 M 和 N 的稳定性: M _______ ( 填 “>” 或 “<”)N 。
(3) 写出 Z 和 N 的水溶液反应的离子方程式: _______ ;
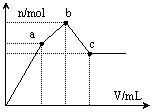
(4)) 上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入 0.1mol·L -1 的 NaOH 溶液,出现了如图中 a 、 b 、 c 三个阶段的图像,根据图像判断该盐的化学式为 _______ 。
答案
H 3 O + 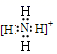 > Al 3+ +3NH 3 ·H 2 O = Al(OH) 3 ↓+3
> Al 3+ +3NH 3 ·H 2 O = Al(OH) 3 ↓+3 NH 4 Al(SO 4 ) 2
【分析】
根据 ② N 溶于 M 中,滴入酚酞,溶液变红,判断 N 为 NH 3 , M 为 H 2 O 。根据 ③ Y 和 K 都由 A.B 两元素组成, Y 核内质子数比 K 多 2 个, Y 为 H 3 O + , K 为 OH — ;根据 ⑤ X 和 K 的浓溶液在加热条件下生成 M 和 N , X 为 NH 4 + ,根据 Z 为单核离子,向含有 Z 的溶液中加入少量含 K 的溶液,有白色沉淀生成,再加入过量的含 K 或 Y 的溶液,沉淀消失, Z 为 Al 3+ ,据此解题。
【详解】
(1)Y 的化学式为 H 3 O + ; X 的电子式为: 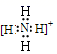 ;
;
故答案为: H 3 O + ; 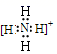 。
。
(2) 比较 M 和 N 的稳定性,即 H 2 O 和 NH 3 的稳定性比较, O 的非金属性大于 N ,故 H 2 O 的稳定性大于 NH 3 ;
故答案为:>。
(3) Z 和 N 的水溶液反应的离子方程式: Al 3+ +3NH 3 ·H 2 O = Al(OH) 3 ↓+3 ;
故答案为: Al 3+ +3NH 3 ·H 2 O = Al(OH) 3 ↓+3 。
(4)) 根据盐与 NaOH 溶液反应图像可知沉淀逐渐增加,恒定一段时间后沉淀溶解,据此判断,除了硫酸根离子,该盐中含有 Al 3+ 和 NH 4 + ,该盐的化学式为 NH 4 Al(SO 4 ) 2 ;
故答案为: NH 4 Al(SO 4 ) 2 。

 (纯氧中发出耀眼的白光)
(纯氧中发出耀眼的白光) (Al2S3在溶液中完全双水解)
(Al2S3在溶液中完全双水解)
 (AlN与水反应生成Al(OH)3和NH3↑)
(AlN与水反应生成Al(OH)3和NH3↑) 




 ,
, ,所以根据得失电子守恒可知:
,所以根据得失电子守恒可知: ,利用此关系可以方便地进行有关计算。
,利用此关系可以方便地进行有关计算。