某兴趣小组同学向一定体积的 Ba(OH) 2 溶液中逐滴滴加稀 H 2 SO 4 ,不断搅拌并测定溶液导电能力的变化 ( 装置如下图所示 ) 。

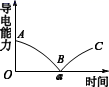
I. 实验测得混合溶液的导电能力随时间变化的曲线如图所示。
(1) 写出 Ba(OH) 2 溶液与稀 H 2 SO 4 反应的离子方程式 _________________ 。
(2) 实验现象:烧杯中有白色沉淀产生,小灯泡 __________________ 。
(3) 下列说法正确的是 __________________ ( 填 “ 序号 ”)
a.AB 段溶液的导电能力不断减弱,说明生成的 BaSO 4 不是电解质
b.B 处溶液的导电能力约为 0 ,说明溶液中几乎没有自由移动的离子
c.a 时刻 Ba(OH) 2 溶液与稀 H 2 SO 4 恰好中和
d.BC 段溶液的导电能力不断增大,主要是由于过量的 Ba(OH) 2 电离出的离子导电
II. 配制 250mL1.0mol/LH 2 SO 4 溶液。
(1) 计算:需要 18mol/LH 2 SO 4 溶液 __________ mL( 计算结果精确到小数点后一位 ) 。
(2) 配制过程中,不需要使用的仪器有 _________________ ( 填 “ 序号 ”) 。
①量筒 ②托盘天平 ③烧瓶 ④ 250ml 容量瓶 ⑤烧杯 ⑥玻璃棒 ⑦胶头滴管
(3) 配制过程中的正确操作顺序是: b 、 d 、 ____________ 、 e( 填 “ 字母 ”) 。
a. 用少量蒸馏水洗涤烧杯和玻璃棒 2 ~ 3 次,洗涤液均注入容量瓶。
b. 用量筒量取所需体积的 18mol/LH 2 SO 4 溶液注入盛有约 50ml 蒸馏水的烧杯。
c. 用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d. 用玻璃棒慢慢搅动,混合均匀。
e. 盖好容量瓶瓶塞,反复上下颠倒,摇匀
f. 将稀释后的 H 2 SO 4 溶液沿玻璃棒注入 250ml 容量瓶。
g. 往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下 1 ~ 2cm 处。
(4) 下列操作将导致所配制的 H 2 SO 4 溶液浓度偏大的是 ________________ ( 填 “ 字母 ”) 。
a. 移液过程有 H 2 SO 4 溶液溅出瓶外 b. 移液后未洗涤烧杯和玻璃棒
c. 定容时俯视容量瓶刻度线 d. 加水超过刻度线,用胶头滴管吸出多余液体
答案
Ba 2+ +2OH - +2H + + =BaSO 4 ↓+2H 2 O 先变暗后变亮 bc 13.9 ②③ f 、 a 、 g 、 c c
【详解】
I 、 (1) Ba(OH) 2 溶液与稀 H 2 SO 4 反应的离子方程式为 Ba 2+ +2OH - +2H + + =BaSO 4 ↓+2H 2 O ,故答案为: Ba 2+ +2OH - +2H + +
=BaSO 4 ↓+2H 2 O ; (2) 反应有沉淀产生,离子浓度减小,导电能力减弱,直至完全反应,灯泡变暗,随着硫酸的增加,导电性又增强先变暗后变亮,故答案为:先变暗后变亮; (3) 硫酸钡为电解质, a 错误, B 点溶液的导电能力约为 0 ,几乎没有自由移动的离子, b 正确, a 点 Ba(OH) 2 溶液与稀 H 2 SO 4 恰好中和,故导电能力为 0 , c 正确, BC 段溶液的导电能力不断增大,主要是由于过量的 H 2 SO 4 电离出的离子导电, d 错误;故答案为: b 、 c ; II 、 (1)
,则
,
13.9ml ,故答案为: 13.9 ; (2) 配置一定物质量浓度的溶液不需要天平与烧瓶,故答案为: ②③ ; (3) 用玻璃棒慢慢搅动,混合均匀之后要将稀释后的 H 2 SO 4 溶液沿玻璃棒注入 250ml 容量瓶,用少量蒸馏水洗涤烧杯和玻璃棒 2 ~ 3 次,洗涤液均注入容量瓶,往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下 1 ~ 2cm 处,用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切,故答案为: f 、 a 、 g 、 c ; (4) 移液中有溶质溅出,浓度偏小,未洗涤烧杯玻璃棒,溶质减少,浓度偏小。定容时俯视读数,读数比实际大,实际液体小于 250ml ,浓度偏大,多加水吸出,溶质减少,浓度偏小,故答案为: c 。




 可知,
可知, 是准 确量取的体积,
是准 确量取的体积, 是标准溶液的浓度,它们均为定值,所以
是标准溶液的浓度,它们均为定值,所以 的大小取决于
的大小取决于 的大小,
的大小, 大则
大则 大,
大, 小则
小则 小。
小。