欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案 ∶
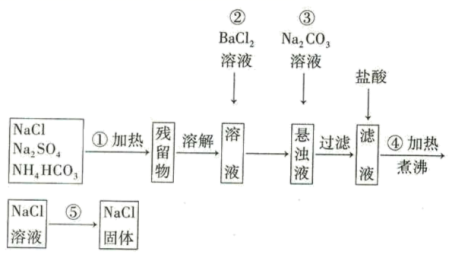
请根据上述操作流程回答下列问题:
(1) 操作 ①在加热时应选择 _______ ( 填仪器名称 ) 盛装混合物。
(2) 进行操作 ②后,判断 SO 已沉淀完全的方法是 _______ 。
(3) 操作 ④的目的是 _______ 。
(4) 实验室进行操作 ⑤的具体步骤是 _______ 。
(5) 某同学欲用制得的氣化钠固体配制 100mL 0.2mol•L -1 的氯化钠溶液。
①配制 NaCl 溶液时需要用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、 _______ 。
②下列操作会使所配制的氯化钠溶液浓度偏低的是 _______ ( 填字母 ) 。
A. 加水定容时俯视刻度线
B. 容量瓶内壁附有水珠而未进行干燥处理
C. 在溶解过程中有少量液体溅出烧杯
D. 颠倒摇匀后发现溶液凹液面低于刻度线又加水补上
答案
坩埚 静置,往上层清液中继续滴加 BaCl 2 溶液,若不出现浑浊,则 已沉淀完全 除去溶液中过量的 HCl 将溶液置于蒸发皿中,加热蒸发,并用玻璃棒不断搅拌,加热至蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热将剩余液体蒸干 胶头滴管、 100mL 容量瓶 CD
【分析】
操作 ①加热后, NH 4 HCO 3 分解为 NH 3 、 CO 2 、 H 2 O ,残留物中只剩下 NaCl 和 Na 2 CO 3 ;操作 ②将残留物配成溶液,加入过量的 BaCl 2 溶液是为了将 Na 2 SO 4 转化为 NaCl 和 BaSO 4 沉淀,以除去 Na 2 SO 4 ;操作 ③继续加入过量的 Na 2 CO 3 溶液,是为了将剩余的 BaCl 2 转化为 NaCl 和 BaCO 3 沉淀,以除去 BaCl 2 ;再加入过量盐酸,是为了除去 Na 2 CO 3 ;操作 ④中,盐酸具有挥发性,可通过加热煮沸除去 HCl ,剩下的溶质是 NaCl ,通过操作 ⑤(蒸发)可得 NaCl 固体。
【详解】
(1) 加热该固体混合物需要在坩埚中进行;
(2) 判断 已除尽的方法是静置后,往上层清液中继续滴加 BaCl 2 溶液,若不出现浑浊,则
已沉淀完全;
(3) 操作 ④的目的是除去溶液中过量的 HCl ;
(4) 操作 ⑤是蒸发,具体步骤是将溶液置于蒸发皿中,加热蒸发,并用玻璃棒不断搅拌,加热至蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热将剩余液体蒸干;
(5) ①配制 NaCl 溶液时需用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、 100mL 容量瓶;
② A .加水定容时俯视刻度线,导致溶液体积偏小,浓度偏高, A 不符合题意;
B .容量瓶内壁附有水珠而未进行干燥处理,不影响所配溶液浓度, B 不符合题意;
C .在溶解过程中有少量液体溅出烧杯,溶质的量减少,浓度偏低, C 符合题意;
D .颠倒摇匀后发现溶液凹液面低于刻度线又加水补上,导致最终溶液体积偏大,浓度偏低, D 符合题意;
故选 CD 。
