某化学实验室需要 0.5mol·L -1 硫酸溶液 450mL 。根据溶液的配制情况回答下列问题:
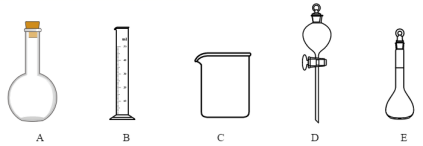
(1) 使用容量瓶之前必须进行的操作是 ___ 。
(2) 如图所示的仪器中配制溶液肯定不需要的是 ___ ( 填序号 ) ,配制上述溶液还需用到的玻璃仪器是 ___ ( 填仪器名称 ) 。
(3) 现用质量分数为 98% 、密度为 1.84g·cm -3 的浓硫酸来配制 450mL 、 0.5mol·L -1 的稀硫酸。计算所需浓硫酸的体积为 ___ mL( 小数点后保留 1 位小数 ) 。
(4) 配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧冷却
其正确的操作顺序为: ② → ① → ③ → → → → → ④ ( 填序号 ) 。 ___
(5) 在配制过程中,其他操作都准确,下列操作中能引起误差偏高的有 ___ 。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的 H 2 SO 4 溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
答案
检查容量瓶是否漏水 AD 玻璃棒、胶头滴管 13.6 ⑧⑤⑥⑦ ①②⑦
【详解】
(1) 因为配制溶液摇匀时需将容量瓶上下颠倒摇匀,故需确保容量瓶瓶塞处不漏水,即使用前必须进行的操作是检查容量瓶是否漏水;
(2) 浓硫酸稀释配制稀硫酸,需要用到以下仪器:容量瓶、量筒(量取浓硫酸)、玻璃棒(转移溶液时引流)、烧杯(稀释浓硫酸)、胶头滴管(定容时用到),所给仪器中 A 、 D 不需要,故此处填 AD ;还缺少胶头滴管、玻璃棒;
(3) 该浓硫酸的物质的量浓度 ,配制 450 mL 溶液,需选用 500 mL 容量瓶,故计算时带入 500 mL 计算,设所需浓硫酸体积为 V ,抓住稀释前后溶质硫酸量不变列式如下: 18.4 mol/L × V mL=0.5 mol/L × 500 mL ,解得 V =13.6 mL ;
(4) 浓硫酸配制稀硫酸的步骤为:计算 ②→量取①→稀释③→冷却⑧→转移⑤→洗涤⑥→定容⑦→摇匀④,故此处填⑧⑤⑥⑦;
(5) ①.量取浓硫酸的量筒不需要洗涤,若洗涤则导致所取浓硫酸偏多,所配稀硫酸浓度偏高,①符合题意;
②.当冷却至室温后,溶液体积缩小,所配溶液浓度偏高,②符合题意;
③.稀释浓硫酸时,应将浓硫酸加入水中,并不断搅拌,③操作错误,不符合题意;
④.由于吸出的溶液中含有溶质硫酸,故容量瓶中剩余溶质偏少,所配溶液浓度偏低,④不符合题意;
⑤.由于定容时需继续加入蒸馏水,故容量瓶原有少量蒸馏水对实验无影响,⑤不符合题意;
⑥.摇匀后,由于刻度线上方残留溶液未及时回落,故液面低于刻度线是正常现象,此时若加水至刻度线,则导致溶液体积偏大,所配溶液浓度偏低,⑥不符合题意;
⑦.俯视刻度线,导致溶液体积偏小,所配溶液浓度偏高,⑦符合题意;
综上所述,此处填 ①②⑦。

