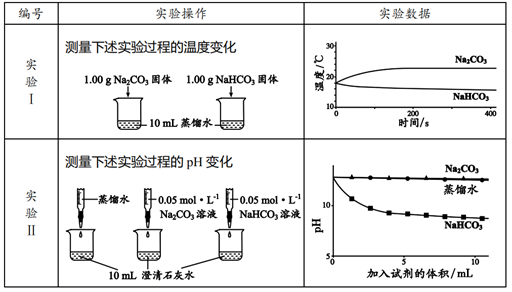
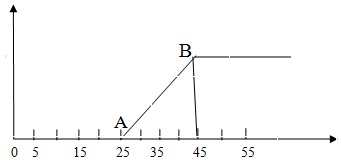
有 10mLNaOH 溶液,问其中逐渐通入一定量的 CO 2 ,然后向该溶液中逐滴加入 1mol·L -1 盐酸,所加入盐酸的体积与产生二氧化碳的体积 ( 标准状况 ) 关系如图所示。
(1)NaOH 在吸收 CO 2 气体后,所得溶液中存在的溶质是 _______ ,其物质的量之比是 _______ 。
(2) 当加入 35mL 盐酸时,所产生的二氧化碳的体积 ( 标准状况 ) 是 _______ 。
(3) 计算原 NaOH 溶液的物质的量浓度是 _______ 。
答案
NaOH 、 Na 2 CO 3 1 : 4 224 4.5 mol·L -1
【分析】
由图象所示消耗的盐酸的体积和产生的 CO 2 的体积间的关系可知,此溶液的溶质是 NaOH 、 Na 2 CO 3 ; OA 段 H + 先与 OH - 反应生成 H 2 O ,再与 CO 3 2- 反应生成 HCO 3 - ;
【详解】
(1)AB 段发生反应的离子方程式为 H + + =CO 2 ↑+ H 2 O , AB 段消耗盐酸 20×1×10 -3 =0.02mol ,则加入盐酸 5 到 25 的过程中发生反应为: H + +
=
、 0 到 5 的过程发生反应为: H + +OH - =H 2 O ,故可得出溶液中存在的溶质为 NaOH 和 Na 2 CO 3 ;比值为 1:4 ;
(2) 当加入 35mL 盐酸时只有 25-35 的过程中产生了气体, n(CO 2 )=(35-25)×10 -3 L×1 mol • L -1 =0.01 mol ,则 V(CO 2 )=224 mL ;
(3) 在 B 点时溶液恰好反应,溶质为 NaCl ,此时氯离子总量等于钠离子总量,则 n(NaOH)=n(Na + )=n(Cl - )=45×10 -3 L×1 mol • L -1 =0.045mol , c(NaOH)=n/V= =4.5 mol·L -1 。