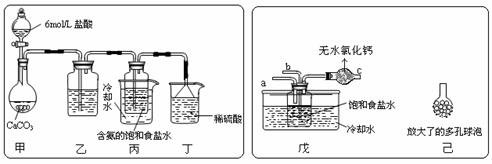
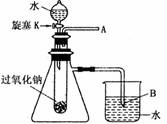
过氧化钠保存不当容易变质,某课外活动小组为了粗略测定样品中过氧化钠的质量分数,他们称取 10.0g 样品,并设计用如图装置来测定过氧化钠的质量分数。
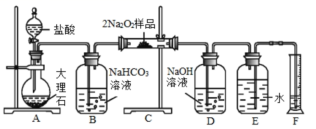
上图中的 E 和 F 构成量气装置,用来测定 O 2 的体积。
(1) 写出以下装置中发生反应的化学方程式。
①装置 A : _______
②装置 B : _______
③装置 C : _______
④装置 D : _______ 。
(2)D 中 NaOH 溶液的作用是 _______ 。
(3) 为准确读出氧气的体积需进行以下操作,正确的顾序为 _______ 。
A. 调整量筒高度,使广口瓶 E 与量筒 F 内液面相平
B. 将气体冷却至室温
C. 平视,使凹液面最低点与视线水平相切再读数
答案
CaCO 3 +2HCl=CaCl 2 +H 2 O+CO 2 ↑ NaHCO 3 +HCl=NaCl+CO 2 ↑ +H 2 O 2Na 2 O 2 +2H 2 O=4NaOH+O 2 ↑ , 2Na 2 O 2 +2CO 2 =2Na 2 CO 3 +O 2 2NaOH+CO 2 = Na 2 CO 3 +H 2 O 吸收混合气体中二氧化碳,便于测量氧气的体积 BAC
【分析】
A 装置盐酸和大理石反应制取二氧化碳, B 装置用来除去挥发的氯化氢, C 装置中过氧化钠和二氧化碳、水反应, D 装置用来吸收未反应的二氧化碳, E 、 F 用来量取生成气体的体积 。 依据量筒读取液体体积时需要先冷却至室温及和集气瓶液面相平确定操作顺序;依据生成氧气的体积计算物质的量,结合化学方程式计算得到过氧化钠物质的量,得到过氧化钠的质量分数,以此解答该题。
【详解】
(1)A 中盐酸和大理石反应生成氯化钙、二氧化碳和水,反应的化学方程式为: CaCO 3 +2HCl=CaCl 2 +H 2 O+CO 2 ↑, B 中二氧化碳中混有氯化氢,氯化氢和碳酸氢钠反应生成氯化钠、二氧化碳和水,反应的化学方程式为: NaHCO 3 +HCl=NaCl+CO 2 ↑ +H 2 O , C 中过氧化钠与水、二氧化碳都反应,反应的化学方程式分别为: 2Na 2 O 2 +2H 2 O=4NaOH+O 2 ↑ , 2Na 2 O 2 +2CO 2 =2Na 2 CO 3 +O 2 , D 装置用来吸收未反应的二氧化碳,反应的化学方程式为: 2NaOH+CO 2 = Na 2 CO 3 +H 2 O 。故答案为: CaCO 3 +2HCl=CaCl 2 +H 2 O+CO 2 ↑; NaHCO 3 +HCl=NaCl+CO 2 ↑ +H 2 O ; 2Na 2 O 2 +2H 2 O=4NaOH+O 2 ↑ , 2Na 2 O 2 +2CO 2 =2Na 2 CO 3 +O 2 ; 2NaOH+CO 2 = Na 2 CO 3 +H 2 O ;
(2) D 装置中氢氧化钠和二氧化碳反应,吸收二氧化碳,便于测量氧气的体积,故答案为:吸收混合气体中二氧化碳,便于测量氧气的体积;
(3) 量筒读取液体体积时需要和集气瓶液面相平,温度在常温下,调整量筒内外液面高度使之相同,使装置内压强和外界压强相同,避免读取体积产生误差,视线与凹液面的最低点相平,再读取量筒中水的体积。为准确读出氧气的体积,操作正确的顺序为: BAC ,故答案为: BAC 。

 ,故钠的金属性比较强,是很活泼的金属材料。其单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
,故钠的金属性比较强,是很活泼的金属材料。其单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。 (白色固体,不稳定)(空气中,钠的切面由银白色逐渐变暗的原因)
(白色固体,不稳定)(空气中,钠的切面由银白色逐渐变暗的原因) (淡黄色固体,较稳定)
(淡黄色固体,较稳定)


 Ti+4NaCl
Ti+4NaCl