将 25 g Na 2 CO 3 、 NaHCO 3 、 NaOH 的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入 1 mol / L 的盐酸,所加入盐酸的体积与产生 CO 2 的体积 ( 标准状况 ) 关系如下图所示:
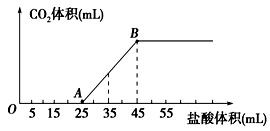
(1) 写出 OA 段所发生反应的离子方程式 ___________ 。
(2) 当加入 35 mL 盐酸时,产生 CO 2 的体积为 ___________ mL( 标准状况 ) 。
(3) 计算原混合物中 NaOH 的质量为 ___________ ,及碳酸钠的质量 ___________ 。
答案
H + +OH - ═H 2 O 、 CO +H + ═HCO
224 0.6g 1.06g
【分析】
根据图象可知,在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,结合图象可知,开始没有二氧化碳气体生成,则制成的稀溶液中的溶质为碳酸钠和氢氧化钠,则 OA 段先发生 H + +OH - ═H 2 O ,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠: CO +H + ═HCO
; AB 段发生反应 HCO
+H + ═CO 2 ↑+H 2 O ,直至加入 45mL 盐酸时反应结束,据此解答。
【详解】
(1) 由上述分析可知, OA 段先发生反应: H + +OH - ═H 2 O ;再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠: CO +H + ═HCO
;故答案为: H + +OH - ═H 2 O 、 CO
+H + ═HCO
;
(2) 结合图象可知,当加入 35mL 盐酸时, 25 ~ 35mL 发生碳酸氢钠与盐酸的反应生成二氧化碳气体,生成气体时消耗的酸的物质的量为( 35-25 ) ×10 -3 L×1mol•L -1 =0.01mol ,根据方程式: HCO +H + ═CO 2 ↑+H 2 O ,生成的 CO2 的物质的量也为 0.01mol ,标准状况下体积为: 0.01mol×22.4L/mol=0.224L=224mL ,故答案为: 224 ;
(3) 设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为 x 、 y 、 z ,则
① x+y=1mol/L× ( 0.045-0.025 ) L
② x+z=1mol/L×0.025L
③ 84g/mol•y+106g/mol•x+40g/mol•z=2.5g
联立 ①②③式解得: x=0.01mol 、 =0.01mol 、 z=0.015mol ,
则原混合物中 NaOH 的质量为: 0.015mol×40g/mol=0.6g ;
碳酸钠的质量为: 0.01mol×106g/mol=1.06g ;
故答案为: 0.6g ; 1.06g 。
【点睛】
考查混合物反应的计算,题目难度中等,明确反应的先后顺序及图象中每段图象对应的化学反应是解答本题的关键。