化工产品中,含氯物质众多,其用途广泛。回答下列问题:
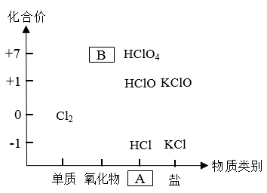
(1) 如图为氯及其化合物的 “ 价一类 ” 二维图。缺失的类别 A 为 ___ 、物质 B 为 ___ ( 填化学式 ) 。
(2) 电石渣 ![]() 是氯碱工业中的废料,某同学在实验室以电石渣为原料制取 KClO 3 的工艺流程如图所示:
是氯碱工业中的废料,某同学在实验室以电石渣为原料制取 KClO 3 的工艺流程如图所示:
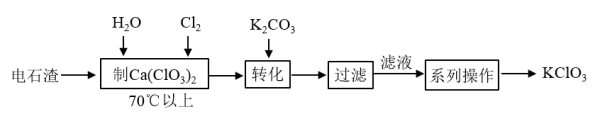
已知 Ca ( ClO 3 ) 2 易溶于水。
① 工业生产电石的反应为 CaO + 3C CaC 2 + CO ,该反应中还原剂为 _____ 。
② 流程中 “ 制 Ca ( ClO 3 ) 2 ” 的化学方程式为 __ ; “ 转化 ” 发生反应的离子方程式为 ___ 。
③ 上述流程中所用 Cl 2 是用 MnO 2 与浓盐酸反应制得。该反应的离子方程式是 ___ ,其中盐酸体现的性质为 ___ 性和 ____ 性。
答案
酸 Cl 2 O 7 C 6Cl 2 + 6Ca(OH) 2 Ca(ClO 3 ) 2 + 5CaCl 2 + 6H 2 O Ca 2+ +
=CaCO 3 ↓
+ 4H + + 2Cl -
Mn 2+ + Cl 2 ↑ + 2H 2 O 酸 还原
【分析】
电石渣 ![]() ,氯气和电石渣在 70℃ 以上温度下反应生成 Ca ( ClO 3 ) 2 、 CaCl 2 和 H 2 O , Ca(ClO 3 ) 2 和 K 2 CO 3 发生反应生成 CaCO 3 沉淀和 KClO 3 溶液,过滤后将滤液经过一系列操作,最终得到 KClO 3 。
,氯气和电石渣在 70℃ 以上温度下反应生成 Ca ( ClO 3 ) 2 、 CaCl 2 和 H 2 O , Ca(ClO 3 ) 2 和 K 2 CO 3 发生反应生成 CaCO 3 沉淀和 KClO 3 溶液,过滤后将滤液经过一系列操作,最终得到 KClO 3 。
【详解】
(1) 如图为氯及其化合物的 “ 价一类 ” 二维图。根据图中信息 A 为酸,物质 B 为 +7 价的氧化物即为 Cl 2 O 7 ;故答案为:酸; Cl 2 O 7 。
(2)① 工业生产电石的反应为 CaO + 3C CaC 2 + CO ,根据反应方程式分析得到碳化合价既升高又降低,因此该反应中还原剂为 C ;故答案为: C 。
② 流程中 “ 制 Ca ( ClO 3 ) 2 ” 主要是 Cl 2 和 Ca(OH) 2 反应生成 Ca(ClO 3 ) 2 、 CaCl 2 和 H 2 O ,其化学方程式为 6Cl 2 + 6Ca(OH) 2 Ca(ClO 3 ) 2 + 5CaCl 2 + 6H 2 O ; “ 转化 ” 主要是 Ca(ClO 3 ) 2 和 K 2 CO 3 发生反应生成 CaCO 3 沉淀和 KClO 3 溶液,其离子方程式为 Ca 2+ +
=CaCO 3 ↓ ;故答案为: 6Cl 2 + 6Ca(OH) 2
Ca(ClO 3 ) 2 + 5CaCl 2 + 6H 2 O ; Ca 2+ +
=CaCO 3 ↓ 。
③ 根据题意 MnO 2 与浓盐酸反应生成 Cl 2 、氯化锰和水,该反应的离子方程式是 + 4H + + 2Cl -
Mn 2+ + Cl 2 ↑ + 2H 2 O ,氯的化合价部分升高,还有一部分化合价未变,因此盐酸体现的性质为酸性和还原性;故答案为:
+ 4H + + 2Cl -
Mn 2+ + Cl 2 ↑ + 2H 2 O ;酸;还原。


