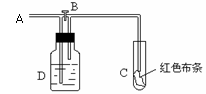
某兴趣小组拟制备氯气并验证其一系列性质。
Ⅰ . (查阅资料)
①当溴水浓度较小时,溶液颜色与氯水相似也呈黄色。
②硫代硫酸钠溶液在工业上可作为脱氯剂。
Ⅱ . (性质验证)实验装置如图所示 ( 省略夹持装置 )
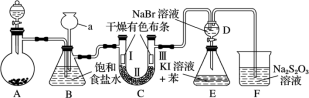
实验步骤: (1) 检查装置气密性,按图示加入试剂。仪器 a 的名称是 __ ;装置 C 中 Ⅱ处加的试剂可以是 ___ ( 选填下列字母编号 ) 。
A. 碱石灰 B. 硅胶 C. 浓硫酸 D. 无水氯化钙
(2) 装置 B 的作用有 ___ 。
(3) 写出装置 F 中相应的离子反应方程式: __ 。
Ⅲ . (探究与反思)
(1) 图中设计装置 D 、 E 的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的,其理由是 __ 。该组的同学思考后将上述 D 、 E 、 F 装置改为如图装置,实验操作步骤如下:
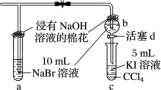
①打开弹簧夹,缓缓通入氯气。
②当 a 和 b 中的溶液都变为黄色时,夹紧弹簧夹。
③当 a 中溶液由黄色变为棕色时,停止通氯气。
④ __ 。
(2) 设计步骤 ③的实验思想是 __ 。
(3) 步骤 ④的操作是 __ 。
答案
长颈漏斗 BD 除去氯气中的氯化氢并作安全瓶 S 2 O +4Cl 2 +5H 2 O=2SO
+8Cl - +10H + 未排除 Cl 2 对溴、碘的非金属性的强弱实验的干扰 对比实验思想 打开活塞 d ,将少量 b 中溶液滴入 c 中,关闭活塞 d ,取下试管 c 振荡
【分析】
装置 A 应制取氯气,然后通过饱和食盐水,除去氯气中的氯化氢气体,在通过干燥的有色布条,检验氯气是否有漂白性,装置 C 中应装固体干燥剂,氯气和溴化钠反应生成氯化钠和溴单质,溴和碘化钾反应生成溴化钾和碘单质,多余的氯气用硫代硫酸钠吸收。据此解答。
【详解】
Ⅱ . (1) 仪器 a 的名称是长颈漏斗;装置 C 中 Ⅱ处加的试剂应为干燥剂,可以是硅胶或无水氯化钙,碱石灰能吸收氯气,此处应放置固体干燥剂,不能选用浓硫酸。
(2) 装置 B 的作用有除去氯气中的氯化氢,有长颈漏斗,可以做安全瓶。
(3) 写出装置 F 中是氯气和硫代硫酸钠反应生成硫酸钠和盐酸,相应的离子反应方程式 S 2 O +4Cl 2 +5H 2 O=2SO
+8Cl - +10H + 。
Ⅲ. (1) 由于在 D 中生成了 Br 2 ,也可能有剩余的 Cl 2 ,当滴入 KI 溶液中时, I 2 的生成也可能是 Cl 2 氧化 I - 生成的,所以未排除 Cl 2 对溴、碘的非金属性的强弱实验的干扰。
(2) 设计步骤 ③的实验思想是对比实验思想。可以保证 Cl 2 和 NaBr 溶液反应, Cl 2 不过量。
(3) 步骤 ④的操作是打开活塞 d ,将少量 b 中溶液滴入 c 中,关闭活塞 d ,取下试管 c 振荡。




 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。  2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。  HCl+HClO
HCl+HClO