二氯化二硫 (S 2 Cl 2 ) 是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知 S 2 Cl 2 具有下列性质:
| 物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
| 剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
| 化学性质 | ① 300 ℃ 以上完全分解 ② S 2 Cl 2 +Cl 2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1) 制取少量 S 2 Cl 2
实验室可利用硫与少量氯气在 110~140℃ 反应制得 S 2 Cl 2 粗品,氯气过量则会生成 SCl 2 。
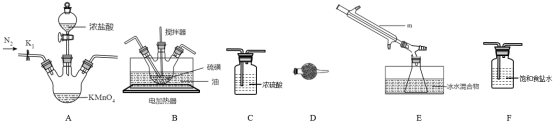
①盛装浓盐酸的仪器名称为 _______ ,将浓盐酸滴下,发生反应的离子方程式 _____
②装置 F 中试剂的作用是 _______ 。
③装置连接顺序: A→ _______ → _______ → ______ →E→D 。
④为了提高 S 2 Cl 2 的纯度,实验的关键是控制好温度和 _______ 。
(2) 少量 S 2 Cl 2 泄漏时应喷水雾减慢其挥发 ( 或扩散 ) ,并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是 _______ 。
(3)S 2 Cl 2 遇水会生成 SO 2 、 HCl 两种气体,某同学设计了如图实验方案来测定该混合气体中 SO 2 的体积分数。

① W 溶液可以是 _____ ( 填标号 ) 。
a. KMnO 4 溶液 ( 硫酸酸化 ) b. H 2 O 2 溶液 c. 氯水
②该混合气体中二氧化硫的体积分数为 _______ ( 用含 V 、 m 的式子表示 ) 。
答案
分液漏斗 +16H + +10Cl - =Mn 2+ + 5Cl 2 ↑+8H 2 O 除去 Cl 2 中混有的 HCl 杂质 F C B 滴入浓盐酸的速率 防止 S 2 Cl 2 遇水分解放热,放出腐蚀性烟气 bc
【分析】
(1) 实验室可利用硫与少量氯气在 110 ~ 140℃ 反应制得 S 2 Cl 2 粗品,氯气过量则会生成 SCl 2 ,利用装置 A 制备氯气,氯气中含氯化氢气体和水蒸气,通过装置 F 除去氯化氢,通过装置 C 除去水蒸气,通过装置 B 和硫磺反应在 110 ~ 140℃ 反应制得 S 2 Cl 2 粗品,通过装置 E 冷凝得到二氯化二硫 (S 2 Cl 2 ) ,连接装置 D 是防止空气中水蒸气进入;
(2)S 2 Cl 2 受热或遇水分解放热,放出腐蚀性烟气;
(3)S 2 Cl 2 遇水会生成 SO 2 、 HCl 两种气体,某同学设计了如下实验方案来测定该混合气体中 SO 2 的体积分数,混合气体通过溶液 W 溶液吸收二氧化硫气体得到溶液中加入加入过量氢氧化钡溶液反应得到硫酸钡沉淀,过滤洗涤干燥称量得到硫酸钡沉淀质量 mg ,元素守恒计算二氧化硫体积分数。
【详解】
(1) ①根据仪器的构造可知,盛装浓盐酸的仪器名称为分液漏斗;将浓盐酸滴下,浓盐酸与高锰酸钾反应生成氯化钾、氯化锰、氯气和水,发生反应的离子方程式为 +16H + +10Cl - =Mn 2+ + 5Cl 2 ↑+8H 2 O ;
②装置 F 中试剂的作用是:除去 Cl 2 中混有的 HCl 杂质;
③利用装置 A 制备氯气,氯气中含氯化氢气体和水蒸气,通过装置 F 除去氯化氢,通过装置 C 除去水蒸气,通过装置 B 和硫磺反应在 110 ~ 140℃ 反应制得 S 2 Cl 2 粗品,通过装置 E 冷凝得到二氯化二硫 (S 2 Cl 2 ) ,连接装置 D 是防止空气中水蒸气进入,依据上述分析可知装置连接顺序为: A→F→C→B→E→D ;
④反应生成 S 2 Cl 2 的氯气过量则会生成 SCl 2 ,温度过高 S 2 Cl 2 会分解,为了提高 S 2 Cl 2 的纯度,实验的关键是控制好温度和滴入浓盐酸的速率或 B 中通入氯气的量;
(2) 少量 S 2 Cl 2 泄漏时应喷水雾减慢其挥发 ( 或扩散 ) ,并产生酸性悬独液,但不要对泄漏物或泄漏点直接喷水,其原因是:防止 S 2 Cl 2 遇水分解放热,放出腐蚀性烟气;
(3) ①三种物质均可以把 SO 2 氧化为硫酸,进而与氢氧化钡反应生成硫酸钡沉淀,但酸性高锰酸钾也能氧化氯化氢,所以 W 溶液可以是双氧水或氯水,不能是酸性高锰酸钾,答案选 bc ;
② mg 固体是硫酸钡,根据硫原子守恒可知 SO 2 的物质的量是 ,所以该混合气体中二氧化硫的体积分数为



 N2+3Cu+3H2O
N2+3Cu+3H2O