已知三氯化铁的熔点为 306 ℃,沸点为 315 ℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:
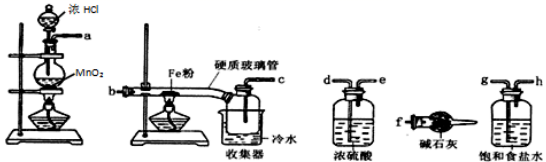
(1) 装碱石灰的仪器是 ___________ ( 填仪器名称 ) 。
(2) 圆底烧瓶中发生反应的离子方程式 ___________ 。
(3) 装置的连接顺序为 a→____→_____→____→___→b→c→f 。 _______
(4) 反应一段时间后想熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油 ( 反应过程中不振荡 ) ,充分反应后,进行如下实验:

①淡黄色溶液中加入试剂 X ,请写出 X 的化学式 ___________ 。
②固体混合物的成分是 ___________ ( 填化学式,已知混合物只有两种物质 )
(5) 已知红色褪去的同时有气体生成,经检验为 O 2 ,该小组同学对红色褪去的原因提出了三种假设。
假设 Ⅰ: H 2 O 2 还原 Fe 3+ ,使其全部转变为 Fe 2+ ;
假设 Ⅱ: H 2 O 2 分解生成 O 2 , O 2 氧化试剂 X :
假设 Ⅲ: ___________ 。
并对假设进行了以下实验研究:
①取褪色后溶液并分成三份,第一份滴加 FeCl 3 溶液无明显变化;第二份滴加试剂 X ,溶液出现红色;第三份滴加稀盐酸和 BaCl 2 溶液,产生白色沉淀。
②另取同浓度的 FeCl 3 溶液滴加 2 滴试剂 X ,溶液变红,再通入 O 2 ,无明显变化。
分析并得出结论:实验 ②说明假设 ___________ 是不正确:实验 ①②得出假设 ___________ 是正确的。
答案
球形干燥管(或干燥管) MnO 2 +4H + +2Cl - Mn 2+ +Cl 2 ↑+2H 2 O g→h→d→e KSCN Fe 、 FeCl 3 H 2 O 2 氧化 KSCN (或 H 2 O 2 氧化试剂 X ) Ⅱ Ⅲ
【分析】
二氧化锰和浓盐酸反应生成氯气,生成的氯气中含有氯化氢和水蒸气,浓硫酸具有吸水性能干燥氯气剂、碱石灰具有碱性,能吸收氯气、饱和食盐水能吸收氯化氢而抑制氯气的溶解,装置排列的顺序为:气体的制取 → 洗气 → 干燥 → 氯气和铁的反应 → 尾气处理;得到的固体混合物中含有氯气与铁反应生成的 FeCl 3 ,还可能含有未反应完全的铁; H 2 O 2 具有强氧化性,可能将 KSCN 氧化,结合实验流程和现象分析解答。
【详解】
(1) 根据图示,装碱石灰的仪器为 ( 球形 ) 干燥管,故答案为: ( 球形 ) 干燥管;
(2) 圆底烧瓶中二氧化锰和浓盐酸反应生成氯气,反应的离子方程式为 MnO 2 +4H + +2Cl - Mn 2+ +Cl 2 ↑+2H 2 O ,故答案为: MnO 2 +4H + +2Cl -
Mn 2+ +Cl 2 ↑+2H 2 O ;
(3) 浓硫酸具有吸水性能干燥氯气剂、碱石灰具有碱性,能吸收氯气、饱和食盐水能吸收氯化氢而抑制氯气的溶解,装置排列的顺序为:气体的制取 → 洗气 → 干燥 → 氯气和铁的反应 → 尾气处理,所以装置连接顺序为 a→g→h→d→e→b→c→f ,故答案为: g→h→d→e ;
(4) ①固体混合物中含有氯气与铁反应生成的 FeCl 3 ,可能含有没有反应的铁,加入过量稀盐酸得到淡黄色溶液,加入试剂 X 溶液呈淡红色,则试剂 X 为 KSCN ,故答案为: KSCN ;
②淡红色溶液中加入过量双氧水得到深红色溶液,说明溶液中 FeCl 3 浓度增大,说明淡红色溶液中含有 FeCl 2 ,则原固体混合物中含有 Fe 、 FeCl 3 ,故答案为: Fe 、 FeCl 3 ;
(5)H 2 O 2 具有强氧化性,可能 KSCN 被 H 2 O 2 氧化了,所以假设 Ⅲ为 H 2 O 2 氧化了 KSCN ,溶液的红色褪去;实验 ①中,第一份滴加 FeCl 3 溶液无明显变化,说明没有 KSCN ;第二份滴加 KSCN ,溶液出现红色,说明溶液中存在 Fe 3+ ;第三份滴加稀盐酸和 BaCl 2 溶液,产生白色沉淀,说明反应后溶液中存在硫酸根离子,证明 KSCN 被氧化,所以假设 Ⅰ错误;实验②中,另取同浓度的 FeCl 3 溶液滴加 2 滴 KSCN ,溶液变红,再通入 O 2 ,无明显变化,说明 O 2 不会氧化 KSCN ,氧化 KSCN 的是 H 2 O 2 ,假设 Ⅱ错误,假设Ⅲ正确,故答案为: H 2 O 2 氧化 KSCN ; Ⅱ;Ⅲ。




 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。  2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。  HCl+HClO
HCl+HClO