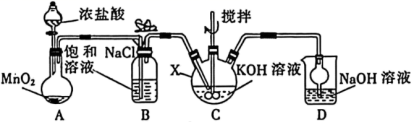
高铁酸钾 (K 2 FeO 4 ) 可溶于水、微溶于浓 KOH 溶液、难溶于无水乙醇;在强碱性溶液中比较稳定,在 Fe 3+ 或 Fe(OH) 3 的催化作用下分解,是一种绿色高效的水处理剂。某实验小组用如图装置 ( 加热夹持仪器已省略 ) 制备 KClO 溶液,再用制得的 KClO 溶液与 Fe(NO 3 ) 3 溶液反应制备 K 2 FeO 4 。
回答下列问题:
(1)K 2 FeO 4 中铁元素的化合价为 _______ ,仪器 X 的名称为 _______ 。
(2) 装置 B 的作用是 _______ ( 任写一点 ) ,装置 D 中发生反应的离子方程式为 _______ 。
(3) 现有 ① Fe(NO 3 ) 3 溶液、 ②含 KOH 的 KClO 溶液,上述两种溶液混合时,将 _______ ( 填标号,下同 ) 滴入 ______ 中,发生的反应中氧化剂与还原剂的物质的量之比为 _______ 。
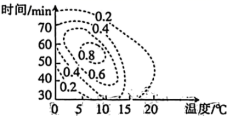
(4) K 2 FeO 4 的理论产率与合成条件相应曲面投影的关系如图 ( 虚线上的数据表示 K 2 FeO 4 的理论产率 ) 所示,则制备 K 2 FeO 4 的最适宜的条件范围是 _______ 。
(5) 高铁酸钾是一种理想的水处理剂,其处理水的原理为 _______ 。
答案
+6 三颈烧瓶 除去氯气中的氯化氢 Cl 2 +2OH - =Cl - +ClO - +H 2 O ① ② 3 : 2 反应时间为 50~60min 时,反应温度为 5~10℃ K 2 FeO 4 具有强氧化性,能杀菌消毒,产生的氢氧化铁胶体具有吸附杂质、絮凝的作用
【分析】
装置 A 中浓盐酸与 MnO 2 共热得到氯气,利用饱和食盐水除去氯气中混有的 HCl ,之后通入 KOH 溶液中得到 KClO 和 KCl 的混合溶液,装置 D 处理尾气,干燥管可以防止倒吸。
【详解】
(1)K 2 FeO 4 中 K 元素为 +1 价, O 为 -2 价,根据化合价之和为 0 可知 Fe 为 +6 价;根据仪器 X 的结构特点可知其为三颈烧瓶;
(2) 浓盐酸具有挥发性,生成的氯气中混有 HCl 气体,饱和 NaCl 溶液可以除去 HCl 气体;装置 D 中是利用 NaOH 溶液反应氯气,处理尾气,离子方程式为 Cl 2 +2OH - =Cl - +ClO - +H 2 O ;
(3) 根据题意可知高铁酸钾在强碱性溶液中比较稳定,所以在制备过程中要保持溶液为碱性环境,即 KOH 要处于过量的状态,所以应将 ①滴入②中;该反应中氧化剂是 KClO ,被还原为 Cl - , Fe(NO 3 ) 3 为还原剂,被氧化为 FeO ,根据电子守恒可知 KClO 和 Fe(NO 3 ) 3 的物质的量之比为 3 : 2 ;
(4) 据图可知当反应时间为 50~60min 时,反应温度为 5~10℃ 时 K 2 FeO 4 的理论产率最高;
(5)K 2 FeO 4 具有强氧化性,能杀菌消毒,其还原产物铁离子水解生成氢氧化铁胶体,具有吸附杂质、絮凝的作用。


