请回答以下问题:
(1) 氢化钠 (NaH) 为白色晶体,其中 有很强的还原性,因此常用氢化钠在高温下将 TiCl 4 还原为 Ti ,自身被氧化为 +1 价。写出其化学反应方程式,并用单线桥标出电子的转移的方向与数目 ___________ ; NaH 能与水剧烈反应 NaH+H 2 O=NaOH+H 2 ↑ , NaH 与液氨也有类似反应,写出反应的化学方程式 ___________ 。
(2) 在 3BrF 3 +5H 2 O=HBrO 3 +Br 2 +9HF+O 2 ↑ 的反应中, 3mol 的 BrF 3 参加反应时,被 H 2 O 所还原的 BrF 3 的物质的量是 ___________ 。
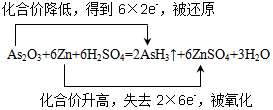
(3) 已知砒霜 As 2 O 3 与 Zn 可以发生如下反应: As 2 O 3 +6Zn+6H 2 SO 4 =2AsH 3 ↑+6ZnSO 4 +3H 2 O
①请用双线桥法标出电子转移的方向和数目 ___________ 。
②若生成 0.2molAsH 3 ,则转移的电子数为 ___________ 。
(4) 氧化氯 (ClO 2 ) 是一种在水处理等方面有广泛应用的高效安全消毒剂,制备 ClO 2 有下列两种方法:
方法一: 2NaClO 3 +4HCl=2ClO 2 ↑+Cl 2 ↑+2NaCl+2H 2 O
方法二: 2NaClO 3 +H 2 O 2 +H 2 SO 4 =2ClO 2 ↑+O 2 ↑+Na 2 SO 4 +2H 2 O
①方法一中氧化剂与还原剂的物质的量之比为 ___________ ;
②若两种方法制备得到相同条件下相同体积的 ClO 2 气体,则两方法中消耗的还原剂质量之比为 ___________ ;
③ Cl 2 与 ClO 2 均用作水处理剂,若它们中的氯元素均被还原为 ,则相同质量的 ClO 2 是 Cl 2 消毒效率的 ___________ 倍。
(5) 配平反应方程式 ( 答题卡上写出完整的化学方程式 ) ___________________ 。
______Al+_______NaNO 3 +_____H 2 O=____Al(OH) 3 +____N 2 ↑+____NaAlO 2
答案
![]() NaH+NH 3 ═NaNH 2 +H 2 ↑
NaH+NH 3 ═NaNH 2 +H 2 ↑ mol
 1.2 N A 1 ∶ 1 73 ∶ 34 2.63 10Al+6NaNO 3 +6H 2 O=4Al(OH) 3 +3N 2 ↑+6NaAlO 2
1.2 N A 1 ∶ 1 73 ∶ 34 2.63 10Al+6NaNO 3 +6H 2 O=4Al(OH) 3 +3N 2 ↑+6NaAlO 2
【分析】
根据氧化还原反应的规律,首先分析物质的元素的化合价,结合化合价升降守恒分析解答。
【详解】
(1)NaH 中 Na 为 +1 价,则 H 为 -1 价,为最低价态,可被氧化,具有还原性,氢化钠在高温下将 TiCl 4 还原为 Ti , H 被氧化为 +1 价,则应生成 HCl ,反应的化学方程式为 2NaH+TiCl 4 ═Ti+2HCl+2NaCl ,电子转移方向和数目可表示为 ![]() ; NaH 能与水剧烈反应 NaH+H 2 O═NaOH+H 2 ↑ ,水为氧化剂,与液氨 (NH 3 ) 也有类似反应,所以 NH 3 作氧化剂, NaH 中 -1 价 H 变为生成物中 0 价的氢, 1 个氢转移 1 个电子,氨气中需 1 个氢原子从 +1 价变为 0 价,反应的化学方程式为 NaH+NH 3 ═NaNH 2 +H 2 ↑ ,故答案为:
; NaH 能与水剧烈反应 NaH+H 2 O═NaOH+H 2 ↑ ,水为氧化剂,与液氨 (NH 3 ) 也有类似反应,所以 NH 3 作氧化剂, NaH 中 -1 价 H 变为生成物中 0 价的氢, 1 个氢转移 1 个电子,氨气中需 1 个氢原子从 +1 价变为 0 价,反应的化学方程式为 NaH+NH 3 ═NaNH 2 +H 2 ↑ ,故答案为: ![]() ; NaH+NH 3 ═NaNH 2 +H 2 ↑ ;
; NaH+NH 3 ═NaNH 2 +H 2 ↑ ;
(2) 3BrF 3 +5H 2 O=HBrO 3 +Br 2 +9HF+O 2 ↑ , H 2 O 中的 O 元素化合价由 -2 价升高到 0 价, BrF 3 中的 Br 元素化合价部分由 +3 价降低到 0 价,部分由 +3 价升高到 +5 价, 3mol 的 BrF 3 参加反应时,有 1molBrF 3 是还原剂, 2molBrF 3 是氧化剂, 1molBrF 3 作还原剂转移 2mol 电子,还原的 BrF 3 为 =
mol ,因此被 H 2 O 所还原的 BrF 3 的物质的量为 2mol-
mol =
mol ,故答案为:
mol ;
(3) ① As 2 O 3 +6Zn+6H 2 SO 4 ═2AsH 3 ↑+6ZnSO 4 +3H 2 O 中 Zn 元素的化合价升高, As 元素的化合价降低,该反应转移的电子为 12e - ,电子转移的方向和数目用双线桥法表示为 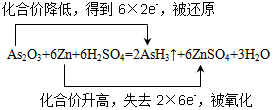 ,故答案为:
,故答案为:  ;
;
②若生成 0.2mol AsH 3 , As 元素的化合价由 +3 价降低为 -3 价,转移的电子数为 0.2mol×6× N A =1.2 N A ,故答案为: 1.2 N A ;
(4) ① 2NaClO 3 +4HCl═2ClO 2 ↑+Cl 2 ↑+2NaCl+2H 2 O 中, NaClO 3 为氧化剂, HCl 为还原剂,只有一半 HCl 作还原剂,氧化剂与还原剂的物质的量之比为 2mol ∶ 2mol=1 ∶ 1 ,故答案为: 1 ∶ 1 ;
②得到相同条件下相同体积的 ClO 2 气体,设均生成 2mol ClO 2 ,方法一中作还原剂的 HCl 为 2mol ,方法二中作还原剂的 H 2 O 2 为 1mol ,两方法中消耗的还原剂质量之比为 2mol×36.5g/mol ∶ 1mol×34g/mol=73 ∶ 34 ,故答案为: 73 ∶ 34 ;
③ Cl 2 与 ClO 2 均用作水处理剂,若它们中的氯元素均被还原为 Cl - ,则相同质量的 ClO 2 是 Cl 2 消毒效率的 =2.63 倍,故答案为: 2.63 ;
(5)Al 元素的化合价由 0 升高为 +3 价, N 元素的化合价由 +5 价降低为 0 ,转移 30mol 电子时, Al 的化学计量数为 10 , NaNO 3 的化学计量数为 6 ,根据得失电子守恒及原子守恒,配平后的反应为 10Al+6NaNO 3 +6H 2 O=4Al(OH) 3 +3N 2 ↑+6NaAlO 2 ,故答案为: 10Al+6NaNO 3 +6H 2 O=4Al(OH) 3 +3N 2 ↑+6NaAlO 2 。



