新型净水剂高铁酸钾 为暗紫色有光泽粉末,微溶于 KOH 溶液,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定,具有高效的消毒作用,是一种新型非氯高效消毒剂。实验小组用下列两种方法制备高铁酸钾。
I 、湿式氧化法制备
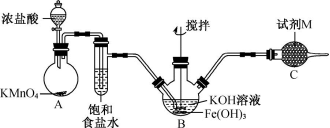
(1)A 中反应的离子反应为 ________________ 。
(2) 实验过程中发现浓盐酸不能持续滴下,装置的改进方案是 ________________________ 写出一种
。
(3)B 中得到紫色固体和溶液, B 中反应的化学方程式为 ________________________ 。
(4) 试剂 M 是 ________ ,其作用为 ________________________ 。
II 、实验室模拟工业电解法制取 ,用镍
、铁作电极电解浓 KOH 溶液制备
的装置如图 1 所示。

(5) 电极作 ________ 极
填 “ 阴 ” 或 “ 阳 ”
。
(6) 电极的电极反应式为 ________________________________________ 。
(7) 高铁电池是正在研制中的可充电干电池,图 2 为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ________ 、 ________ 。
答案
2MnO +16H + +10Cl - =2Mn 2+ +5Cl 2
+8H 2 O 将分液漏斗改为恒压滴液漏斗
或恒压分液漏斗
,或者在分液漏斗与圆底烧瓶间连接一段橡皮管
碱石灰 吸收氯气,防止污染空气; 阳 Fe+8OH - -6e - = FeO
+4H 2 O 放电时间长 工作电压稳定
【分析】
湿式氧化法制备高铁酸钾的原理为:利用 A 装置制备氯气,其反应为 , A 装置和 B 装置之间的饱和食盐水用于洗去氯气中的 HCl , C 装置中为碱石灰,用于吸收多余的氯气,防治污染空气。
【详解】
I.(1)A 中为制取氯气的反应,写成离子方程式为 ,故填
;
(2) 浓盐酸不能顺利滴下,可能是因为烧瓶内压强与分液漏斗不一致,故可将分液漏斗改为恒压滴液漏斗,或者在分液漏斗与圆底烧瓶间连接一段橡皮管,故填将分液漏斗改为恒压滴液漏斗,或者在分液漏斗与圆底烧瓶间连接一段橡皮管;
(3)B 中为制备高铁酸钾,其反应为 ,故填
;
(4)C 中试剂 M 为碱石灰,用于吸收多余的氯气,防治污染空气,故填碱石灰、吸收氯气,防止污染空气;
II.(5) 根据题意,图 1 中铁作为阳极,被氧化,在碱性条件下失电子生成高铁酸根,其电极反应为 ,故填阳;
(6) 图 1 中铁作阳极,失电子,生成产物,其电极反应为 ,故填
;
(7) 从图 2 中可以看出,高铁电池工作电压稳定,放电时间长,故填放电时间长、工作电压稳定。


