为测试铁片中铁元素的含量,某课外活动小组提出下面方案并进行了实验。将 0.200g 铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用 0.0200mol•L -1 的 KMnO 4 溶液滴定,达到终点时消耗了 25.00mLKMnO 4 溶液。
(1) 配平以下方程式并标出电子转移的方同与数目: ___ 。
H 2 SO 4 +KMnO 4 +FeSO 4 →MnSO 4 +Fe 2 (SO 4 ) 3 +K 2 SO 4 +H 2 O
(2) 铁片中铁元素的质量分数为 ___ ;若通过仪器分析发现该小组的测量结果偏高,以下可能的情况有 ___ 。
A. 酸式滴定管洗净后,直接注入高锰酸钾溶液
B. 洗净的锥形瓶,再用待测液润洗
C. 锥形瓶中残留有少量蒸馏水
D. 滴定至终点时,在滴定管尖嘴部位有气泡
(3) 高锰酸钾溶液往往用硫酸酸化而不用盐酸酸化,原因是: ___ 。
(4)Fe 2 (SO 4 ) 3 溶液中 c(Fe 3+ ) : c(SO ) ___ 2 : 3( 填写 “>” 、 “<” 或 “=”) ,用离子方程式解释: ___ 。
(5) 高锰酸钾在化学品生产中,广泛用作为氧化剂,可以氧化 H 2 O 2 、 Fe 2+ 、 S 2- 、 SO 等多种物质。如 H 2 O 2 +KMnO 4 +H 2 SO 4 →MnSO 4 + +K 2 SO 4 +H 2 O ,试推测空格上应填物质的化学式为 ___ 。
(6) 上述反应在恒温下进行,该过程中会明显看到先慢后快的反应,原因可能是 ___ 。
答案
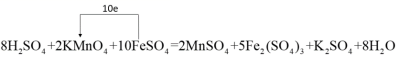 70% AB 盐酸具有还原性,易被高锰酸钾氧化 < Fe 3+ +3H 2 O
70% AB 盐酸具有还原性,易被高锰酸钾氧化 < Fe 3+ +3H 2 O Fe(OH) 3 +3H + O 2 生成的锰离子具有催化作用,加快反应速率
【详解】
(1) 元素的化合价变化为: Mn : +7→+2 ,改变数为 5 , Fe : +2→+3 ,改变数为 1 ,根据化合价升降的总数相等可知, KMnO 4 与 FeSO 4 的化学计量数比值为 1 : 5 ,然后根据质量守恒配平化学方程式,配平后的化学方程式为 2KMnO 4 +10FeSO 4 +8H 2 SO 4 =5Fe 2 (SO 4 ) 3 +2MnSO 4 +K 2 SO 4 +8H 2 O ,标出电子转移的方同与数目后为 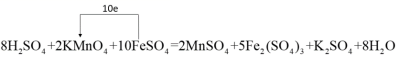 ,故答案为:
,故答案为: 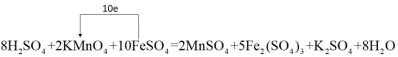 ;
;
(2) 实验过程中发生反应: Fe+H 2 SO 4 =FeSO 4 +H 2 ↑ 、 2KMnO 4 +10FeSO 4 +8H 2 SO 4 =5Fe 2 (SO 4 ) 3 +2MnSO 4 +K 2 SO 4 +8H 2 O ,则 n(Fe)=n(FeSO 4 )=5n(KMnO 4 )=5×0.02000mol L -1 ×0.025L=0.0025mol ; m(Fe)=56×0.0025g=0.14g ,质量分数 w(Fe)=
=70% ; AB ;
A .酸式滴定管洗净后,没有用标准液润洗,直接注入高锰酸钾溶液,会得到测得标准 V(KMnO 4 ) 偏大,最终测量结果偏高,故 A 选;
B .洗净的锥形瓶,再用待测液润洗,会导致待测液物质的量增大,最终测量结果偏高,故 B 选;
C .滴定至终点时,在滴定管尖嘴部位有气泡会导致测得标准 V(KMnO 4 ) 偏小,最终测量结果偏低,故 C 不选;
故选 AB ;故答案为: 70% ;
(3) 盐酸中 Cl - 具有还原性,易被高锰酸钾氧化,所以高锰酸钾溶液往往用硫酸酸化而不用盐酸酸化,故答案为:盐酸具有还原性,易被高锰酸钾氧化;
(4)Fe 2 (SO 4 ) 3 在溶液中完全电离生成 Fe 3+ 和 SO 离子,电离方程式为 Fe 2 (SO 4 ) 3 =2Fe 3+ +3SO
, Fe 3+ 在水溶液中会水解 Fe 3+ +3H 2 O
Fe(OH) 3 +3H + ,形成 Fe(OH) 3 ,则 c(Fe 3+ ) : c(SO
)<2 : 3 ,故答案为: < ; Fe 3+ +3H 2 O
Fe(OH) 3 +3H + ;
(5) 该反应中 Mn 元素由 +7 价下降到 +2 价,根据氧化还原反应得失电子守恒的规律, H 2 O 2 中 O 元素将由 -1 价上升到 0 价,生成 O 2 ,故答案为: O 2 ;
(6) 反应过程中生成了锰离子,具有催化作用,加快反应速率,故答案为:生成的锰离子具有催化作用,加快反应速率。



