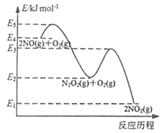
“ 绿水青山就是金山银山 ” ,研究氮氧化物等大气污染物对建设美丽家乡,打造宜居环境具有重要意义。 NO 在空气中存在如下反应: 2NO(g)+ O 2 (g) ![]() 2NO 2 (g) △ H 上述反应分两步完成,如下左图所示。
2NO 2 (g) △ H 上述反应分两步完成,如下左图所示。

(1) 写出反应 ①的热化学方程式 ( △ H 用含物理量 E 的等式表示 ) : ________ 。
(2) 反应 ①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定 2NO(g)+O 2 (g) ![]() 2NO 2 (g) 反应速率的是 ____ ( 填 “ 反应 ① ” 或 “ 反应 ② ”) ;对该反应体系升高温度,发现总反应速率变慢,其原因可能是 ____ ( 反应未使用催化剂 ) 。
2NO 2 (g) 反应速率的是 ____ ( 填 “ 反应 ① ” 或 “ 反应 ② ”) ;对该反应体系升高温度,发现总反应速率变慢,其原因可能是 ____ ( 反应未使用催化剂 ) 。
(3) 某温度下一密闭容器中充入一定量的 NO 2 ,测得 NO 2 浓度随时间变化的曲线如上图所示。前 5 秒内 O 2 的平均生成速率为 _______ ;该温度下反应 2NO+O 2 ![]() 2NO 2 的化学平衡常数 K 为 _____ 。
2NO 2 的化学平衡常数 K 为 _____ 。
(4) 对于 (3) 中的反应体系达平衡后 ( 压强为 P 1 ) ,若升高温度,再次达平衡后,混合气体的平均相对分子质量 _____ ( 填 “ 增大 ” 、 “ 减小 ” 或 “ 不变 ”) ;若在恒温恒容条件下,向其中充入一定量 O 2 ,再次达平衡后,测得压强为 P 2 , c(O 2 )=0.09mol·L -1 ,则 P 1 ︰ P 2 = ___________ 。
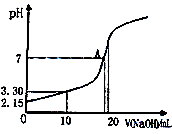
(5) 水能部分吸收 NO 和 NO 2 混合气体得到 HNO 2 溶液。若向 20.00mL0.10mol·L -1 HNO 2 溶液中逐滴加入 0.10mol·L -1 NaOH 溶液,所得 pH 曲线如图所示,则 A 点对应的溶液 c(Na + )/c(HNO 2 )= ____ 。
答案
① 2NO(g) ![]() N 2 O 2 (g) ΔH= ( E 2 - E 3 ) kJ · mol - 1 ; 反应 ②; 决定总反应速率是反应 ②,温度升高后反应①平衡逆向移动,造成 N 2 O 2 浓度减小,温度升高对于反应 ②的影响弱于 N 2 O 2 浓度减小的影响, N 2 O 2 浓度减小导致反应 ②速率变慢; 0.001 mol · L -1 · s -1 ; 100 ; 减少; 5 : 13 ; 10 3.70 ;
N 2 O 2 (g) ΔH= ( E 2 - E 3 ) kJ · mol - 1 ; 反应 ②; 决定总反应速率是反应 ②,温度升高后反应①平衡逆向移动,造成 N 2 O 2 浓度减小,温度升高对于反应 ②的影响弱于 N 2 O 2 浓度减小的影响, N 2 O 2 浓度减小导致反应 ②速率变慢; 0.001 mol · L -1 · s -1 ; 100 ; 减少; 5 : 13 ; 10 3.70 ;
【详解】
( 1 )根据图像反应 ①的热化学方程式为 2NO(g) ![]() N 2 O 2 (g) ΔH= ( E 2 - E 3 ) kJ·mol - 1 。
N 2 O 2 (g) ΔH= ( E 2 - E 3 ) kJ·mol - 1 。
( 2 )根据图像反应 ①的活化能 < 反应 ②的活化能,反应①为快反应,反应②为慢反应,决定 2NO(g)+O 2 (g) ![]() 2NO 2 (g) 反应速率的是慢反应 ②。对该反应体系升高温度,发现总反应速率变慢,其原因可能是:决定总反应速率是反应②,温度升高后反应①平衡逆向移动,造成 N 2 O 2 浓度减小,温度升高对于反应 ②的影响弱于 N 2 O 2 浓度减小的影响, N 2 O 2 浓度减小导致反应 ②速率变慢。
2NO 2 (g) 反应速率的是慢反应 ②。对该反应体系升高温度,发现总反应速率变慢,其原因可能是:决定总反应速率是反应②,温度升高后反应①平衡逆向移动,造成 N 2 O 2 浓度减小,温度升高对于反应 ②的影响弱于 N 2 O 2 浓度减小的影响, N 2 O 2 浓度减小导致反应 ②速率变慢。
( 3 )前 5s 内 υ ( NO 2 ) = ( 0.04mol/L-0.03mol/L ) ÷5s=0.002mol/(L·s) ,则 υ ( O 2 ) =0.001mol/(L·s) 。用三段式:
2NO 2 ![]() 2NO+O 2
2NO+O 2
c (始) 0.04 0 0
c (变) 0.02 0.02 0.01
c (平) 0.02 0.02 0.01
反应 2NO 2 ![]() 2NO+O 2 的平衡常数为 ( 0.02 2 × 0.01) ÷ 0.02 2 =0.01 ,则反应 2NO+O 2
2NO+O 2 的平衡常数为 ( 0.02 2 × 0.01) ÷ 0.02 2 =0.01 ,则反应 2NO+O 2 ![]() 2NO 2 的平衡常数 K 为 1÷0.01=100 。
2NO 2 的平衡常数 K 为 1÷0.01=100 。
( 4 )根据图像反应 2NO 2 ![]() 2NO+O 2 为吸热反应,对于 (3) 中的反应体系达平衡后 ( 压强为 P 1 ) ,若升高温度,平衡正向移动,再次达平衡后,混合气体的质量不变,混合气体物质的量增大,混合气体的平均相对分子质量减小。再通入一定量 O 2 ,平衡逆向移动,设转化 NO 物质的量浓度为 x ,则平衡时 NO 2 、 NO 、 O 2 的浓度依次为( 0.02+x ) mol/L 、( 0.02-x ) mol/L 、 0.09mol/L ,温度不变平衡常数不变,则
2NO+O 2 为吸热反应,对于 (3) 中的反应体系达平衡后 ( 压强为 P 1 ) ,若升高温度,平衡正向移动,再次达平衡后,混合气体的质量不变,混合气体物质的量增大,混合气体的平均相对分子质量减小。再通入一定量 O 2 ,平衡逆向移动,设转化 NO 物质的量浓度为 x ,则平衡时 NO 2 、 NO 、 O 2 的浓度依次为( 0.02+x ) mol/L 、( 0.02-x ) mol/L 、 0.09mol/L ,温度不变平衡常数不变,则 ![]() ,解得 x=0.01mol/L ,即平衡时 NO 2 、 NO 、 O 2 的浓度依次为 0.03mol/L 、 0.01mol/L 、 0.09mol/L ,在恒温恒容时压强之比等于物质的量浓度之比, P 1 : P 2 = ( 0.02+0.02+0.01 ):( 0.03+0.01+0.09 ) =5:13 。
,解得 x=0.01mol/L ,即平衡时 NO 2 、 NO 、 O 2 的浓度依次为 0.03mol/L 、 0.01mol/L 、 0.09mol/L ,在恒温恒容时压强之比等于物质的量浓度之比, P 1 : P 2 = ( 0.02+0.02+0.01 ):( 0.03+0.01+0.09 ) =5:13 。
( 5 )根据图像 0.1mol/LHNO 2 溶液的 pH=2.15 ,则 HNO 2 的电离平衡常数 K a = ( 1 × 10 -2.15 ) 2 ÷ ( 0.1-1 × 10 -2.15 ); A 点溶液呈中性, c ( H + ) =c ( OH - ) =1 × 10 -7 mol/L ,溶液中电荷守恒为 c ( H + ) +c ( Na + ) =c ( OH - ) +c ( NO 2 - ),则 A 点溶液中 c ( Na + ) =c ( NO 2 - ), A 点对应的溶液中 =
=K a ÷ c ( H + ) =
![]() ÷ ( 1 × 10 -7 ) =10 3.70 。
÷ ( 1 × 10 -7 ) =10 3.70 。