利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
( 1) 汽车尾气的主要污染物为 NO ,用 H 2 催化还原 NO 可以达到消除污染的目的。
已知: 2NO(g) ![]() N 2 (g)+O 2 (g) ΔH=-180.5 kJ·mol - 1
N 2 (g)+O 2 (g) ΔH=-180.5 kJ·mol - 1
2H 2 O(l)===2H 2 (g)+O 2 (g) ΔH=+571.6 kJ·mol - 1
写出 H 2 (g) 与 NO(g) 反应生成 N 2 (g) 和 H 2 O(l) 的热化学方程式是 ______________ 。
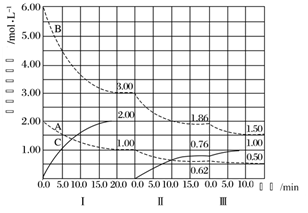
( 2) 某研究小组模拟研究如下:向 2 L 恒容密闭容器中充入 2 mol NO 发生反应 2NO(g) ![]() N 2 (g)+O 2 (g) ,在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N 2 (g)+O 2 (g) ,在不同的温度下,反应过程中物质的量与时间的关系如图所示:
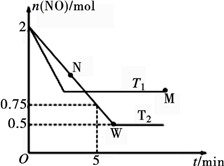
①T 2 下,在 0~5 min 内, v(O 2 )= ______________ mol·L - 1 ·min - 1 ;该温度下反应 N 2 (g)+O 2 (g) ![]() 2NO(g) 的平衡常数 K= ______________ 。
2NO(g) 的平衡常数 K= ______________ 。
② 该反应进行到 M 点放出的热量 ______________ 进行到 W 点放出的热量 ( 填 “>”、“<” 或 “=”)。
M 点时再加入一定量 NO ,平衡后 NO 的转化率 ______________ ( 填 “ 变大 ”、“ 变小 ” 或 “ 不变 ”)。
③ 反应开始至达到平衡的过程中,容器中下列各项发生变化的是 ______________ ( 填序号 )。
a .混合气体的密度 b .逆反应速率
c .单位时间内, N 2 和 NO 的消耗量之比 d .气体的平均相对分子质量
( 3) 氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物: LaNi 5 (s)+3H 2 (g) ![]() LaNi 5 H 6 (s) ΔH<0 ,欲使 LaNi 5 H 6 (s) 释放出气态氢,根据平衡移动原理,可改变的条件是 ______________ ( 填字母编号 )。
LaNi 5 H 6 (s) ΔH<0 ,欲使 LaNi 5 H 6 (s) 释放出气态氢,根据平衡移动原理,可改变的条件是 ______________ ( 填字母编号 )。
A .增加 LaNi 5 H 6 (s) 的量 B .升高温度
C .使用催化剂 D .减小压强
答案
2H 2 (g)+2NO(g)===N 2 (g)+2H 2 O(l) ΔH=-752.1 kJ·mol - 1 6.25×10 - 2 ![]() 或 0.44 < 不变 bc BD
或 0.44 < 不变 bc BD
【解析】
试题分析:本题主要考查热化学方程式的书写,化学平衡图像的分析,化学反应速率和化学平衡常数的计算 , 外界条件对化学平衡的影响。
( 1) 将反应编号: 2NO(g) ![]() N 2 ( g)+O 2 ( g)ΔH=-180.5 kJ·mol - 1 ( ① 式)
N 2 ( g)+O 2 ( g)ΔH=-180.5 kJ·mol - 1 ( ① 式)
2H 2 O(l)=2H 2 ( g)+O 2 ( g)ΔH=+571.6 kJ·mol - 1 ( ② 式)
应用盖斯定律, ① 式 -② 式得 2H 2 ( g)+2NO(g)=N 2 ( g)+2H 2 O(l)ΔH=(-180.5kJ/mol)-(+571.6kJ/mol)=-752.1kJ/mol,H 2 ( g) 与 NO(g) 反应生成 N 2 ( g) 和 H 2 O(l) 的热化学方程式为 2H 2 ( g)+2NO(g)=N 2 ( g)+2H 2 O(l)ΔH=-752.1kJ/mol。
( 2)①T 2 下在 0~5min 内 , υ(NO)= ![]() =
= ![]() =0.125mol/(L·min), 则 υ(O 2 ) =
=0.125mol/(L·min), 则 υ(O 2 ) = ![]() υ(NO)=0.0625mol/(L·min )。由图像可见该温度下达到平衡时 n(NO)=0.5mol, 用三段式
υ(NO)=0.0625mol/(L·min )。由图像可见该温度下达到平衡时 n(NO)=0.5mol, 用三段式
2NO(g) ![]() N 2 ( g)+O 2 ( g)
N 2 ( g)+O 2 ( g)
n (起始)( mol) 2 0 0
n (转化)( mol) 1.5 0.75 0.75
n (平衡)( mol) 0.5 0.75 0.75
平衡时 NO、N 2 、 O 2 物质的量浓度依次为 0.25mol/L、0.375mol/L、0.375mol/L, 反应的平衡常数 = ![]() =
= ![]() =
= ![]() , 则反应 N 2 ( g)+O 2 ( g)
, 则反应 N 2 ( g)+O 2 ( g) ![]() 2NO(g) 的平衡常数 K=
2NO(g) 的平衡常数 K= ![]() =
= ![]() =0.44。
=0.44。
② 反应进行到 M 点转化 NO 物质的量小于反应进行到 W 点转化 NO 物质的量,反应进行到 M 点放出的热量 ![]() 进行到 W 点放出的热量。 M 点时再加入一定量 NO ,平衡向正反应方向移动,加入 NO 相当于增大压强(增大压强平衡不移动 ), 平衡后 NO 的转化率不变。
进行到 W 点放出的热量。 M 点时再加入一定量 NO ,平衡向正反应方向移动,加入 NO 相当于增大压强(增大压强平衡不移动 ), 平衡后 NO 的转化率不变。
③a, 该反应中所有物质都呈气态,根据质量守恒定律,气体的总质量始终不变,容器容积不变,混合气体的密度始终不变; b, 反应开始逆反应速率为 0, 反应开始至达到平衡过程中逆反应速率增大,达平衡时逆反应速率不变; c ,单位时间内 N 2 的消耗量表示逆反应速率,单位时间内 NO 的消耗量表示正反应速率,从反应开始至达到平衡的过程中,逆反应速率增大,正反应速率减小,单位时间内 N 2 和 NO 的消耗量之比增大; d, 该反应中所有物质都呈气态,根据质量守恒定律,气体的总质量始终不变,该反应反应前后气体分子数不变,气体分子物质的量始终不变,气体的平均相对分子质量始终不变;从开始至达到平衡的过程,发生变化的是 bc, 答案选 bc。
( 3)A ,增加 LaNi 5 H 6 ( s )的量,平衡不移动 , 不会释放出气态氢 ; B ,正反应为放热反应,升高温度平衡向逆反应方向移动,释放出气态氢; C, 使用催化剂,平衡不移动,不会释放出气态氢; D, 减小压强,平衡向逆反应方向移动,释放出气态氢;使 LaNi 5 H 6 ( s )释放出气态氢,可改变的条件是升高温度、减小压强,答案选 BD。

 pC(g)+qD(g)
pC(g)+qD(g)  。
。 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。  qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。