多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
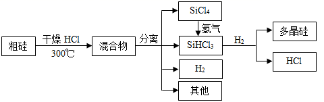
回答下列问题:
Ⅰ .硅粉与 在 300℃ 时反应生成
气体和
,放出
热量,该反应的热化学方程式为 ________________________ 。
的电子式为 __________________ 。
Ⅱ .将 氢化为
有三种方法,对应的反应依次为:
①
②
③
( 1 )氢化过程中所需的高纯度 可用惰性电极电解
溶液制备,写出产生
的电极名称 ______ (填 “ 阳极 ” 或 “ 阴极 ” ),该电极反应方程式为 ________________________ 。
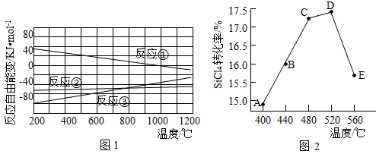
( 2 )已知体系自由能变 ,
时反应自发进行。三个氢化反应的
与温度的关系如图 1 所示,可知:反应 ① 能自发进行的最低温度是 ____________ ;相同温度下,反应 ② 比反应 ① 的
小,主要原因是 ________________________ 。
( 3 )不同温度下反应 ② 中 转化率如图 2 所示。下列叙述正确的是 ______ (填序号)。
a . B 点: b .
: A 点
点 c .反应适宜温度:
℃
( 4 )反应 ③ 的 ______ (用
,
表示)。温度升高,反应 ③ 的平衡常数
______ (填 “ 增大 ” 、 “ 减小 ” 或 “ 不变 ” )。
( 5 )由粗硅制备多晶硅过程中循环使用的物质除 、
和
外,还有 ______ (填分子式)。
答案
 阴极
阴极 或
1000℃
导致反应 ② 的
小 a 、 c
减小
、
【分析】
I. 书写热化学方程式时一定要标注出各物质的状态,要将热化学方程式中焓变的数值与化学计量数对应。本题的反应温度需要标注为条件;
II. ( 1 )惰性电极电解 KOH 溶液,实质是电解水,产生氢气的必为阴极,发生还原反应。
( 2 ) “ 看图说话 ” ,将反应 ① 的纵、横坐标对应起来看,即可顺利找到最低温度。影响自由能变的因素主要是焓变和熵变,分析发现熵变对反应 ② 反而不利,说明焓变影响大,为主要影响因素;
( 3 )据图判断化学平衡的建立和移动是分析的关键。注意时间是一个不变的量。
( 4 )此问是盖斯定律的简单应用,对热化学方程式直接进行加减即可。
【详解】
I. 参加反应的物质是固态的 Si 、气态的 HCl ,生成的是气态的 SiHCl 3 和氢气,反应条件是 300℃ ,配平后发现 SiHCl 3 的化学计量数恰好是 1 ,由此可顺利写出该条件下的热化学方程式: Si(s)+3HCl(g) ![]() SiHCl 3 (g)+H 2 (g) ∆H=-225kJ·mol -1 ; SiHCl 3 中硅与 1 个 H 、 3 个 Cl 分别形成共价单键,由此可写出其电子式为:
SiHCl 3 (g)+H 2 (g) ∆H=-225kJ·mol -1 ; SiHCl 3 中硅与 1 个 H 、 3 个 Cl 分别形成共价单键,由此可写出其电子式为: ![]() ,注意别漏标 3 个氯原子的孤电子对;
,注意别漏标 3 个氯原子的孤电子对;
II. ( 1 )电解 KOH 溶液,阳极发生氧化反应而产生 O 2 、阴极发生还原反应才产生 H 2 ;阴极的电极反应式可以直接写成 2H + +2e - =H 2 ↑ ,或写成由水得电子也可以: 2H 2 O+2e - =H 2 ↑+2OH - ;
( 2 )由题目所给的图 1 可以看出,反应 ① (最上面那条线)当 ∆G=0 时,对应的横坐标温度是 1000℃ ;从反应前后气体分子数的变化来看,反应 ① 的熵变化不大,而反应 ② 中熵是减小的,可见熵变对反应 ② 的自发更不利,而结果反应 ② 的 ∆G 更负,说明显然是焓变产生了较大的影响,即 ∆H 2 <∆H 1 导致反应 ② 的 ∆G 小(两个反应对应的 ∆H ,一个为正值,一个为负值,大小比较很明显);
( 3 )图 2 给的是不同温度下的转化率,注意依据控制变量法思想,此时所用的时间一定是相同的,所以图示中 A 、 B 、 C 点反应均正向进行, D 点刚好达到平衡, D 点到 E 点才涉及平衡的移动。在到达平衡状态以前,正反应速率大于逆反应速率, a 项正确, B 点反应正向进行,正反应速率大于逆反应速率; b 点错误,温度越高,反应速率越快,所以 E 点的正(或逆)反应速率均大于 A 点; c 项正确, C 到 D 点, SiHCl 3 的转化率较高,选择此温度范围比较合适,在实际工业生产中还要综合考虑催化剂的活性温度。
( 4 )将反应 ① 反向,并与反应 ② 直接相加可得反应 ③ ,所以 ∆H 3 =∆H 2 -∆H 1 ,因 ∆H 2 <0 、 ∆H 1 >0 ,所以 ∆H 3 必小于 0 ,即反应 ③ 正反应为放热反应,而放热反应的化学平衡常数随着温度的升高而减小;
( 5 )反应 ① 生成的 HCl 可用于流程中粗硅提纯的第 1 步,三个可逆反应中剩余的 H 2 也可循环使用。
【点睛】
① 对于反应的吉布斯自由能大小比较及变化的分析,要紧紧抓住焓判据和熵判据进行分析。 ② 判断图 2 中时间是一个不变的量,是看清此图的关键。明白了自变量只有温度,因变量是 SiCl 4 的转化率,才能落实好平衡的相关知识的应用,如平衡的建立,平衡的移动以及平衡常数随温度变化的规律等。