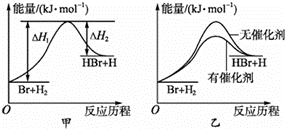
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为 N 2 (g) 和 O 2 (g) 反应生成 NO(g) 过程中的能量变化,下列说法中正确的是
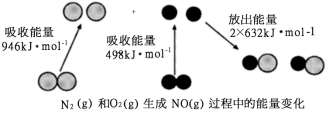
A . 1mol N 2 (g) 和 1mol O 2 (g) 完全反应放出的能量为 180kJ
B . 通常情况下, N 2 (g) 和 O 2 (g) 混合能直接生成 NO
C . 1mol N 2 (g) 和 1mol O 2 (g) 具有的总能量小于 2mol NO(g) 具有的总能量
D . NO 是一种红棕色的气体,能与水反应生成硝酸
答案
C
【详解】
A .反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则生成 2molNO 的反应热是( 946 + 498 - 2 × 632 ) kJ / mol = 180kJ / mol ,因此 1mol N 2 ( g )和 1mol O 2 ( g )完全反应吸收的能量为 180kJ ,故 A 错误; B . N 2 ( g )和 O 2 ( g )放电或高温下反应生成 NO ,故 B 错误; C .为吸热反应,则 1mol N 2 ( g )和 1mol O 2 ( g )具有的总能量小于 2mol NO ( g )具有的总能量,故 C 正确; D . NO 为无色气体,与水不反应,故 D 错误;故答案为 C 。