(1)室温下,使用pH计测定0.1 mol/LNH4Cl溶液的pH=5.12。由此可以得到的结论是_______(填字母)。
a.溶液中c(H+)>c(OH-)
b.NH4+水解是微弱的
c.NH3·H2O是弱碱
d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.1 mol/LNaOH溶液分别滴定20.00 mL 0.1 mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
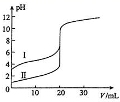
①表示滴定盐酸的曲线是_______(填序号)。
②滴定醋酸溶液的过程中:
ⅰ.V(NaOH)=10.00 mL时,溶液中离子浓度由大到小的顺序为_________。
ⅱ.当c(Na+)=c(CH3COO—)+c(CH3COOH)时,溶液pH____7(填“>”、“=”或“<”)。
答案
abcⅡc(CH3COO-)>c(Na+)>c(H+)>c(OH-)>
【解析】
(1)室温下,使用pH计测定0.1mol/LNH4Cl溶液的pH=5.12,即溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3•H2O为弱碱。则
a、溶液pH=5.12,即溶液显酸性,故溶液中c(H+)>c(OH-),a正确;
b、NH3•H2O为弱碱,故NH4+是弱碱阳离子,在水溶液中能水解,但一般的水解程度很微弱,b正确;
c、溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3•H2O为弱碱,c正确;
d、NH4Cl为强酸弱碱盐,在水溶液中能水解,而盐的水解能促进水的电离,故此溶液中由H2O电离出的c(H+)>10-7mol/L,d错误;
e、物质的量浓度相等的氨水和盐酸等体积混合,恰好完全反应得NH4Cl溶液,但由于NH4Cl为强酸弱碱盐,水解显酸性,故溶液的pH<7,e错误;
答案选abc;
(2)①醋酸是弱电解质,HCl是强电解质,相同浓度的醋酸和HCl溶液,醋酸的pH>盐酸的pH,所以I是滴定醋酸的曲线,Ⅱ表示的是滴定盐酸的曲线;
②i、V(NaOH)=10.00mL时,因此溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(Na+)<c(CH3COO—),故离子浓度的关系为c(CH3COO—)>c(Na+)>c(H+)>c(OH-);
ii、当c(Na+)=c(CH3COO—)+c(CH3COOH),根据物料守恒可知,加入的NaOH溶液的物质的量与醋酸的物质的量相同,此时两者恰好完全反应得醋酸钠溶液,而醋酸钠为强碱弱酸盐,水解显碱性,故溶液的pH>7。
【点睛】
本题考查了酸碱混合溶液定性判断,涉及弱电解质的电离、盐类水解、酸碱中和反应等知识点,根据弱电解质的电离特点、溶液酸碱性及盐类水解等知识点来分析解答,题目难度中等。注意溶液中电荷守恒、物料守恒的灵活应用。




 可知,
可知, 是准 确量取的体积,
是准 确量取的体积, 是标准溶液的浓度,它们均为定值,所以
是标准溶液的浓度,它们均为定值,所以 的大小取决于
的大小取决于 的大小,
的大小, 大则
大则 大,
大, 小则
小则 小。
小。