下列离子方程式与所述事实相符且书写正确的是
A.用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.碱性镉镍可充电电池的正极反应:NiO(OH)-e-+H2O==Ni(OH)2+OH-
C.AgOH沉淀溶于氨水:![]()
D.已知苯甲酸的酸性比碳酸强,向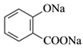 溶液中通入过量CO2:
溶液中通入过量CO2: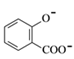 + 2CO2 + 2H2O —→
+ 2CO2 + 2H2O —→![]() + 2HCO
+ 2HCO![]()
答案
C
【解析】分析:A、阳极铁溶解生成Fe2+,与阴极附近H+放电后生成的OH-结合生成Fe(OH)2沉淀;B、电池的正极是得电子的一极;C、Ag+与NH3分子形成配合离子![]() ,使AgOH沉淀溶解;D、只能是较强的酸与较弱酸的盐发生反应。
,使AgOH沉淀溶解;D、只能是较强的酸与较弱酸的盐发生反应。
详解:A、电解时,铁作阳极,失去电子而溶解,生成Fe2+,阴极上由于H+放电生成氢气,破坏了水的电离平衡,使溶液中OH-浓度增大,进而与Fe2+反应生成Fe(OH)2沉淀,所以A不正确;
B、电池的负极失去电子,电子经导线流向电池的正极,所以正极是得电子的一极,故B不正确;
C、Ag+具有空轨道,而NH3分子具有孤对电子,二者可以形成配合离子![]() ,使AgOH沉淀溶解,所以C正确;
,使AgOH沉淀溶解,所以C正确;
D、苯甲酸的酸性比碳酸的强,碳酸的酸性比苯酚的强,向![]() 溶液中通入过量CO2,只能与酚钠—ONa反应,而不能与羧酸钠—COONa反应,所以D不正确。本题答案为C。
溶液中通入过量CO2,只能与酚钠—ONa反应,而不能与羧酸钠—COONa反应,所以D不正确。本题答案为C。
点睛:本题把常见的知识进行变化处理,换角度去思考,把复杂问题简单化,更有利于解答,如B选项,若注重电极反应式是否正确,就很难判断,但若注重电子的得失,即负极失电子,正极得电子,立即可确定是否正确。


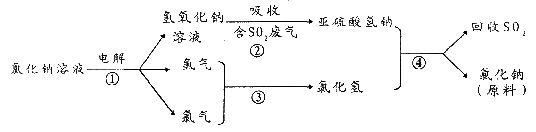
 H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。
H2↑+Cl2↑+2NaOH 离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。