探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ. ![]()
![]()
Ⅱ. ![]()
![]()
Ⅲ. ![]()
![]()
回答下列问题:
(1)![]() _________
_________![]() 。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为__________mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

已知:CO2的平衡转化率=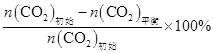
CH3OH的平衡产率=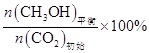
其中纵坐标表示CO2平衡转化率的是图___________(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________;图乙中T1温度时,三条曲线几乎交于一点的原因是___________。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________(填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
答案
+40.9 ![]()
![]() 乙 p1、p2、p3 T1时以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响 A
乙 p1、p2、p3 T1时以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响 A
【分析】
根据盖斯定律计算反应热;利用三个反应,进行浓度和化学平衡常数的计算;结合图形根据勒夏特列原理考虑平衡移动的方向,确定温度和压强变化时,CO2的平衡转化率和CH3OH的平衡产率之间的关系得到相应的答案。
【详解】
(1).根据反应I-II=III,则△H3=△H1-△H2=-49.5kJ∙mol-1-(-90.4 kJ∙mol-1)=+40.9 kJ∙mol-1;
(2).假设反应II中,CO反应了xmol,则II生成的CH3OH为xmol,I生成的CH3OH为(a-x)mol,III生成CO为(b+x)mol,根据反应I: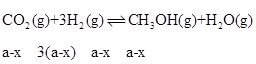 ,反应II:
,反应II: 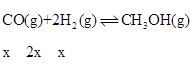 ,反应III:
,反应III: ,所以平衡时水的物质的量为(a-x)mol+(b+x)mol =(a+b)mol,浓度为:
,所以平衡时水的物质的量为(a-x)mol+(b+x)mol =(a+b)mol,浓度为:![]() ;平衡时CO2的物质的量为1mol-(a-x)mol-(b+x)mol=(1-a-b)mol,H2的物质的量为3mol-3(a-x)mol-2x-(b+x)mol=(3-3a-b)mol,CO的物质的量为bmol,水的物质的量为(a+b)mol,则反应III的平衡常数为:
;平衡时CO2的物质的量为1mol-(a-x)mol-(b+x)mol=(1-a-b)mol,H2的物质的量为3mol-3(a-x)mol-2x-(b+x)mol=(3-3a-b)mol,CO的物质的量为bmol,水的物质的量为(a+b)mol,则反应III的平衡常数为: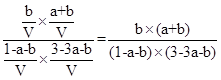 ;
;
(3).反应I和II为放热反应,升高温度,平衡逆向移动,则CH3OH的平衡产率减少,所以图甲表示CH3OH的平衡产率,图乙中,开始升高温度,由于反应I和II为放热反应,升高温度,平衡逆向移动,CO2的平衡转化率降低,反应III为吸热反应,升高温度反应III向正反应方向移动,升高一定温度后以反应III为主,CO2的平衡转化率又升高,所以图乙表示CO2的平衡转化率;压强增大,反应I和II是气体体积减小的反应,反应I和II平衡正向移动,反应III气体体积不变化,平衡不移动,故压强增大CH3OH的平衡产率增大,根据图所以压强关系为:p1>p2>p3;温度升高,反应I和II平衡逆向移动,反应III向正反应方向移动,所以T1温度时,三条曲线交与一点的原因为:T1时以反应III为主,反应III前后分子数相等,压强改变对平衡没有影响;
(4).根据图示可知,温度越低,CO2的平衡转化率越大,CH3OH的平衡产率越大,压强越大,CO2的平衡转化率越大,CH3OH的平衡产率越大,所以选择低温和高压,答案选A。
【点睛】
本题为化学反应原理综合题,考查了盖斯定律、化学平衡常数的计算、勒夏特列原理进行图像的分析,难点为平衡常数的计算,巧用了三个反应的化学方程式,进行了数据的处理,得到反应III的各项数据,进行计算得到平衡常数。




