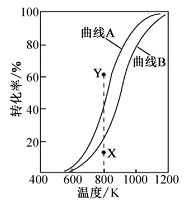
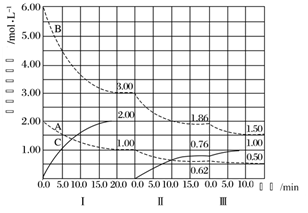
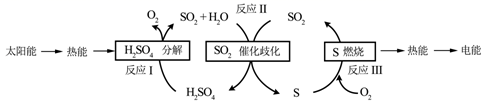
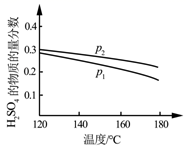
工业上利用Ga与NH3高温条件下合成固体半导体材料氮化稼(GaN)同时有氢气生成。反应中,每生成3molH2时放出30.8kJ的热量。恒温恒容密闭体系内进行上述反应, 下列有关表达正确的是

A.I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.II图像中纵坐标可以为镓的转化率
C.III图像中纵坐标可以为化学反应速率
D.IV图像中纵坐标可以为体系内混合气体平均相对分子质量
答案
A
【详解】
A.I图象中如果纵坐标为正反应速率,升高温度或增大压强,反应速率增大,图象符合题意,A正确;
B.Ga是固体,没有浓度可言,不能计算其转化率,B错误;
C.Ga是固体,其质量不影响反应速率,C错误;
D.反应方程式为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H<0,相同压强下,升高温度,平衡逆向移动,平均相对分子质量增大;相同温度下,增大压强,平衡逆向移动,平均相对分子质量增大,D错误;
2GaN(s)+3H2(g)△H<0,相同压强下,升高温度,平衡逆向移动,平均相对分子质量增大;相同温度下,增大压强,平衡逆向移动,平均相对分子质量增大,D错误;
答案选A。

 pC(g)+qD(g)
pC(g)+qD(g)  。
。 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。  qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。