从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是__(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如图(部分操作和条件略):
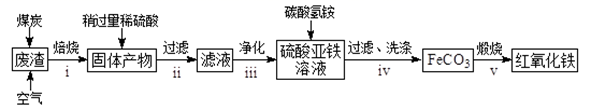
回答下列问题:
①在步骤i中产生的有毒气体可能有__。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时![]() =1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5mol/L,则溶液的pH为___。
=1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5mol/L,则溶液的pH为___。
③步骤iv中,生成FeCO3的离子方程式是__。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入适量氧化铜粉末会产生沉淀,写出这一过程的总反应的离子方程式__。
(4)古老而神奇的蓝色染料普鲁士蓝的合成方法如图:

复分解反应ⅱ的离子方程式是__。
答案
c CO和SO2等 5 Fe2++2HCO![]() =FeCO3↓+CO2↑+H2O 3CuO+2Fe3++3H2O=2Fe(OH)3+3Cu2+
=FeCO3↓+CO2↑+H2O 3CuO+2Fe3++3H2O=2Fe(OH)3+3Cu2+ ![]()
【详解】
(1)古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁,选c,故答案为:c;
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%,加煤炭焙烧可生成CO、SO2等有毒气体,加硫酸后只有二氧化硅不反应,过滤除去二氧化硅,然后调节pH,Fe3+和Al3+完全转化为沉淀,而亚铁离子没有转化为沉淀,向滤液加入碳酸氢铵将溶液中Fe2+转变为碳酸亚铁沉淀,过滤得到碳酸亚铁,洗涤、干燥,然后煅烧得到氧化铁。
①根据以上分析可知在步骤i中产生的有毒气体可能有CO和SO2等。
②在步骤ⅲ操作中,要除去的离子之一为Al3+。若常温时![]() =1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5mol/L,则此时溶液中氢氧根浓度是
=1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5mol/L,则此时溶液中氢氧根浓度是![]() mol/L=1.0×10-9 mol/L,所以溶液的pH=5。
mol/L=1.0×10-9 mol/L,所以溶液的pH=5。
③步骤ⅳ中,根据原子守恒可知生成FeCO3的同时还有二氧化碳和水生成,则离子方程式是Fe2++2HCO![]() =FeCO3↓+CO2↑+H2O;
=FeCO3↓+CO2↑+H2O;
(3)因为Fe3+会水解产生较多的H+:Fe3++3H2O![]() Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀,总反应式为3CuO+2Fe3++3H2O=2Fe(OH)3+3Cu2+;
Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀,总反应式为3CuO+2Fe3++3H2O=2Fe(OH)3+3Cu2+;
(4)![]() 和Fe3+反应生成
和Fe3+反应生成![]() 蓝色沉淀,反应的离子方程式为:3
蓝色沉淀,反应的离子方程式为:3![]() +4Fe3+=
+4Fe3+=![]() ↓。
↓。


 Ag+(aq)+Cl-(aq),加入AgNO3,平衡向沉淀方向移动,Cl-减少。
Ag+(aq)+Cl-(aq),加入AgNO3,平衡向沉淀方向移动,Cl-减少。  转变为
转变为 沉淀而除去。
沉淀而除去。 
 等作沉淀剂,使某些金属离子如
等作沉淀剂,使某些金属离子如 等生成极难溶的硫化物
等生成极难溶的硫化物
 等沉淀,也是分离、除杂常用的方法。
等沉淀,也是分离、除杂常用的方法。
 时即沉淀完全。
时即沉淀完全。  平衡就会向沉淀溶解的方向移动,使沉淀溶解。
平衡就会向沉淀溶解的方向移动,使沉淀溶解。  沉淀中加入
沉淀中加入 溶液,
溶液, 结合生成
结合生成 使
使 的溶解平衡向右移动。
的溶解平衡向右移动。 




 中加入饱和
中加入饱和 溶液使
溶液使 转化为
转化为 再将
再将 溶于盐酸。
溶于盐酸。