铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;![]() 中 Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
中 Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
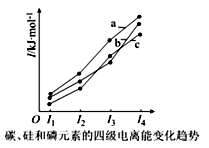
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
| 元素 | Fe | Cu |
| 第一电离能 I1/kJ·mol-1 | 759 | 746 |
| 第二电离能 I2/kJ·mol-1 | 1561 | 1958 |
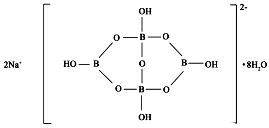
(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 ![]() 。
。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(5)氧化亚铁晶体的晶胞结构如图所示。已知:

氧化亚铁晶体的密度为 ρg•cm﹣3,NA代表阿伏加德罗常数的值。在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
答案
ds 直线形 ![]() 失去第二个电子时,Cu 失去的是全充满 3d10 电子,Fe 失去的是 4s1 电子
失去第二个电子时,Cu 失去的是全充满 3d10 电子,Fe 失去的是 4s1 电子 ![]() 12NA BCD 12
12NA BCD 12 ![]() ×1010
×1010
【分析】
(1)Ag在第五周期第ⅠB族;依题意:![]() 中Ag+以sp杂化成键;
中Ag+以sp杂化成键;
(2)铜是29号元素,分析Cu+基态核外电子排布式;
(3)根据电子排布分析;
(4)①CN-与N2是等电子体,结构相似,根据氮气电子式书写;CN-与Fe2+以配位键结合,这6个配位键都属于σ键,还有6个CN-中各有一个σ键;
②根据![]() 分子式分析;
分子式分析;
(5)根据晶胞,Fe2+为面心立方,与Fe2+紧邻且等距离的Fe2+数目为12个;晶胞参数等于相邻两个离子核间距的2倍。
【详解】
(1)Ag在第五周期第ⅠB族,属于ds区;依题意:![]() 中Ag+以sp杂化成键,应该是直线形,故答案为:ds;直线形;
中Ag+以sp杂化成键,应该是直线形,故答案为:ds;直线形;
(2)铜是29号元素,Cu+基态核外电子排布式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)Cu+的价电子排布式为3d10,Fe+的价电子排布式为3d64s1,Cu+再失去的是3d10上的电子,而Fe+失去的是4s1的电子,由于原子核外电子处于全充满、半充满或全空时是稳定的状态,显然3d10处于全充满,更稳定,所以失去第二个电子时,Cu 失去的是全充满 3d10 电子,需要的能量高,而Fe 失去的是4s1 电子,所需能量低,故答案为:失去第二个电子时,Cu 失去的是全充满 3d10 电子,Fe 失去的是 4s1 电子;
(4)①CN-与N2是等电子体,结构相似,根据氮气电子式书写氢氰根离子电子式为![]() ;CN-与Fe2+以配位键结合,这6个配位键都属于σ键,还有6个CN-中各有一个σ键,1个配离子中含有的σ键共有12个,则1mol该配离子中含有 12 NA个σ键,故答案为:
;CN-与Fe2+以配位键结合,这6个配位键都属于σ键,还有6个CN-中各有一个σ键,1个配离子中含有的σ键共有12个,则1mol该配离子中含有 12 NA个σ键,故答案为:![]() ;12NA;
;12NA;
②![]() 是离子化合物,含有离子键,阳离子K+与配离子之间以离子键结合,Fe2+与CN-以配位键结合,CN-中的两种原子以极性共价键结合, 故答案为:BCD;
是离子化合物,含有离子键,阳离子K+与配离子之间以离子键结合,Fe2+与CN-以配位键结合,CN-中的两种原子以极性共价键结合, 故答案为:BCD;
(5)根据晶胞,Fe2+为面心立方,与Fe2+紧邻的等距离的Fe2+有12个;用“均摊法”,晶胞中含Fe2+:8![]() +6
+6![]() =4个,含O2-:12
=4个,含O2-:12![]() +1=4个,晶体的化学式为FeO,1molFeO的质量为72g,1mol晶体的体积为
+1=4个,晶体的化学式为FeO,1molFeO的质量为72g,1mol晶体的体积为![]() cm3;晶胞的体积为
cm3;晶胞的体积为![]() cm3
cm3![]() NA
NA![]() 4=
4=![]() cm3,晶胞的边长为
cm3,晶胞的边长为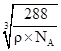 cm,Fe2+与O2-最短核间距为
cm,Fe2+与O2-最短核间距为 cm=
cm=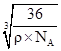 cm=
cm= 1010pm,故答案为:12;
1010pm,故答案为:12;![]() ×1010。
×1010。
【点睛】
本题考查了物质结构和性质,涉及晶胞计算、离子晶体熔沸点影响因素、配合物、等电子体等知识点,难点是晶胞计算,用“均摊法”确定晶胞中所含微粒的个数,注意氮化铁的晶胞不是平行六面体,是六方晶胞,处于顶点的粒子,同时为6个晶胞共有,每个粒子有1/6属于该晶胞;处于面心的粒子,同时为2个晶胞共有,每个粒子有1/2属于该晶胞;处于体内的粒子,完全属于该晶胞。