由次氯酸钠碱性废水(含有杂质Ca2+)处理硫酸工业尾气的流程如下:

(1)次氯酸钠不稳定,温度较高时会分解生成NaClO3,该反应的化学方程式为_____。
(2)控制合适的条件有利于提高SO2的吸收率(脱硫率)。
①脱硫时需保持溶液呈碱性,此过程的主要反应之一为:SO2+2OH-=![]() +H2O;另一个为氧化还原反应,请写出该反应的离子方程式:_____________。
+H2O;另一个为氧化还原反应,请写出该反应的离子方程式:_____________。
②提高脱硫率的可行措施有_______(填序号)。
a.加快通入尾气的速率
b.吸收塔中喷淋的碱液与气体逆向接触
c.提高碱液pH
③温度控制在40~60 ℃之间,脱硫率较高,原因是_________________。
(3)脱硫完成后过滤。
①滤渣的主要成分为___________(填化学式)。
②滤液中含有较多的Na2SO4和NaCl,需实现两者分离。其中得到高纯度Na2SO4·10H2O晶体的方法是:___________________,过滤,冰水洗涤,重结晶。
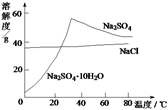
答案
3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3 ![]() +ClO-=
+ClO-=![]() + Cl-(或SO2 + ClO-+ 2OH-=
+ Cl-(或SO2 + ClO-+ 2OH-=![]() + Cl-+ H2O) bc 温度过低,反应速率慢;温度过高NaClO不稳定分解(或温度过高SO2溶解度减小) CaSO4(或CaSO4·2H2O) 30℃左右加热浓缩,冰水冷却结晶(或冷却至0℃结晶)
+ Cl-+ H2O) bc 温度过低,反应速率慢;温度过高NaClO不稳定分解(或温度过高SO2溶解度减小) CaSO4(或CaSO4·2H2O) 30℃左右加热浓缩,冰水冷却结晶(或冷却至0℃结晶)
【分析】
(1)次氯酸钠在温度较高时会分解生成NaClO3和NaCl,根据电子守恒、原子守恒书写反应方程式;
(2)①ClO-具有强氧化性,+4价的S具有还原性,二者会发生氧化还原反应,据此书写反应方程式;
②结合物质的存在状态及化学反应速率影响因素分析判断;
③温度控制在40~60 ℃之间,脱硫率较高,原因是从反应速率、物质的稳定性、气体的溶解度等方面分析判断;
(3)根据废水中含有的微粒及物质的溶解性判断滤渣成分,结合物质溶解度与温度关系曲线分析判断提纯硫酸钠晶体的方法。
【详解】
(1)次氯酸钠不稳定,温度较高时会发生分解反应生成NaClO3和NaCl,反应方程式为:3NaClO![]() 2NaCl+NaClO3;
2NaCl+NaClO3;
(2)①脱硫时需保持溶液呈碱性,此过程的主要反应之一为:SO2+2OH-=![]() +H2O;由于ClO-具有强氧化性,+4价的S具有还原性,二者会发生氧化还原反应,该反应的离子方程式为
+H2O;由于ClO-具有强氧化性,+4价的S具有还原性,二者会发生氧化还原反应,该反应的离子方程式为![]() +ClO-=
+ClO-=![]() + Cl-(或SO2 + ClO-+ 2OH-=
+ Cl-(或SO2 + ClO-+ 2OH-=![]() + Cl-+ H2O);
+ Cl-+ H2O);
②a.SO2是气体,若加快通入尾气的速率,会导致SO2未反应就随气体逸出,使脱硫率降低,a不符合题意;
b.吸收塔中喷淋的碱液与气体逆向接触,可以使反应物质充分接触,反应更充分,因而就可以提高脱硫率,b符合题意;
c.提高碱液pH,可以使SO2被充分吸收,因而使脱硫率大大提高,c符合题意;
故合理选项是bc;
③温度控制在40~60 ℃之间,脱硫率较高,这是由于温度过低,反应速率较慢;弱温度过高,NaClO不稳定受热会发生分解,同时温度过高导致SO2溶解度减小,也使反应利于脱硫反应的进行;
(3)①由次氯酸钠碱性废水中含有杂质Ca2+,当用其处理硫酸厂尾气水,SO2被氧化为![]() ,
,![]() 与Ca2+结合形成溶解度较小的CaSO4析出,所以滤渣的主要成分为CaSO4(或其结晶水合物CaSO4·2H2O);
与Ca2+结合形成溶解度较小的CaSO4析出,所以滤渣的主要成分为CaSO4(或其结晶水合物CaSO4·2H2O);
②根据物质溶解性随温度变化曲线可知:NaCl的溶解度受温度的影响变化不到,Na2SO4·10H2O的溶解度在温度接近40℃时随温度的升高而增大,在温度为30℃二者的溶解度相等,低于30℃使NaCl的溶解度比Na2SO4·10H2O的大,所以要从含有较多的Na2SO4 和NaCl滤液中分离提纯,得到高纯度Na2SO4·10H2O晶体的方法是:在30℃左右加热浓缩,冰水冷却结晶(或冷却至0℃结晶)。
【点睛】
本题考查了化学反应硫酸厂尾气处理的应用。涉及化学反应速率影响因素、方程式的书写、混合物的分离提纯。综合考查了学生对氧化还原反应、离子反应、化学反应速率理论的掌握及视图能力分析问题能力在混合物分离中的应用。



