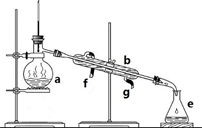
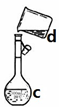
蓝色钾盐水合物KaCub(C2O4)c·H2O(铜元素为+2价)的组成可通过下列实验确定:
步骤①:称取一定质量的样品置于锥形瓶中,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.0200 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00 mL(![]() 的还原产物为Mn2+)。
的还原产物为Mn2+)。
步骤②:充分加热滴定后的溶液,冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI,发生反应2Cu2++4I—=2CuI↓+I2
步骤③:加入少量淀粉溶液作指示剂,用0.0200 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液15.00 mL,发生反应I2+2![]() =2I—+
=2I—+![]()
(1)步骤①中需事先配制好250 mL 0.0200 mol·L-1KMnO4标准溶液,配制KMnO4溶液时除需用到烧杯、玻璃棒外,还用到的玻璃仪器有_______、_______。
(2)若步骤②中未对滴定后的溶液进行加热,则测出的Cu2+的物质的量将_______(填“偏大”、“偏小” 或“不变”) 。
(3)步骤③中滴定终点的现象是______________。
(4)通过计算确定a:b:c=________________。(请写出计算过程)。
答案
250mL容量瓶 胶头滴管 偏大 溶液由蓝色变为无色,且半分钟内不变色 2:1:2
【分析】
(1)根据配制一定体积一定物质的量浓度的溶液的操作判断使用的仪器;
(2)加热可促使![]() 分解产生Mn2+反应,避免对后面实验产生干扰;
分解产生Mn2+反应,避免对后面实验产生干扰;
(3)I2遇淀粉溶液变为蓝色,据此判断滴定终点现象;
(4)根据![]() 标准溶液的物质的量计算
标准溶液的物质的量计算![]() 的物质的量;根据反应消耗Na2S2O3标准溶液的体积计算Cu2+的物质的量,最后根据电荷守恒可计算K+的物质的量,再计算出各种离子的物质的量的整数比,即得到a:b:c的比值。
的物质的量;根据反应消耗Na2S2O3标准溶液的体积计算Cu2+的物质的量,最后根据电荷守恒可计算K+的物质的量,再计算出各种离子的物质的量的整数比,即得到a:b:c的比值。
【详解】
(1)配制250 mL 0.0200 mol·L-1KMnO4标准溶液,除需用到烧杯、玻璃棒外,还用到的玻璃仪器有250 ml容量瓶及胶头滴管;
(2)在酸性条件下KMnO4具有强的氧化性,可以与I-发生氧化还原反应产生I2。若步骤②中未对滴定后的溶液进行加热除去![]() ,
,![]() 会氧化后面为测定Cu2+而加入的I-,反应产生I2,使产生I2的物质的量增多,导致测出的Cu2+的含量偏大;
会氧化后面为测定Cu2+而加入的I-,反应产生I2,使产生I2的物质的量增多,导致测出的Cu2+的含量偏大;
(3)在溶液中发生反应:2Cu2++4I-=2CuI↓+I2,以淀粉溶液作指示剂,由于I2遇淀粉溶液变为蓝色,所以用0.0200 mol•L-1Na2S2O3标准溶液进行滴定时,发生反应:I2+2![]() =2I-+
=2I-+![]() ,随着标准溶液的加入,I2浓度逐渐降低,溶液蓝色逐渐变浅,当滴加最后一滴Na2S2O3标准溶液时,溶液恰好由蓝色变为无色,且半分钟内不再变为蓝色,说明此时反应达到了滴定终点。故滴定终点的实验现象是:溶液由蓝色变为无色,且半分钟内不变色;
,随着标准溶液的加入,I2浓度逐渐降低,溶液蓝色逐渐变浅,当滴加最后一滴Na2S2O3标准溶液时,溶液恰好由蓝色变为无色,且半分钟内不再变为蓝色,说明此时反应达到了滴定终点。故滴定终点的实验现象是:溶液由蓝色变为无色,且半分钟内不变色;
(4)根据电子守恒可知关系式:5![]() ~2
~2![]() ,所以n(C2O42-)=2.5n(C2O42-)=2.5×0.0200 mol/L×12.00 mL×10-3 L/mL=6.000×10-4 mol;
,所以n(C2O42-)=2.5n(C2O42-)=2.5×0.0200 mol/L×12.00 mL×10-3 L/mL=6.000×10-4 mol;
根据方程式2Cu2++4I-=2CuI↓+I2、I2+2![]() =2I-+
=2I-+![]() ,可得关系式:2Cu2+~I2~2
,可得关系式:2Cu2+~I2~2![]() ,所以n(Cu2+)=2n(I2)=n(
,所以n(Cu2+)=2n(I2)=n(![]() )=0.0200 mol/L×15.00 mL×10-3 L/mL=3.000×10-4 mol;
)=0.0200 mol/L×15.00 mL×10-3 L/mL=3.000×10-4 mol;
根据电荷守恒可得:n(K+)+2n(Cu2+)=2n(![]() ),则n(K+)+2×3.000×10-4 mol=2×6.000×10-4 mol,解得n(K+)=6.000×10-4 mol,所以,n(K+):n(Cu2+):n(
),则n(K+)+2×3.000×10-4 mol=2×6.000×10-4 mol,解得n(K+)=6.000×10-4 mol,所以,n(K+):n(Cu2+):n(![]() )=2:1:2,故a:b:c=2:1:2。
)=2:1:2,故a:b:c=2:1:2。
【点睛】
本题考查探究物质组成与含量的方法,明确实验原理,掌握物质反应转化关系为解答关键,注意掌握关系式法在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力。