下列说法中正确的是
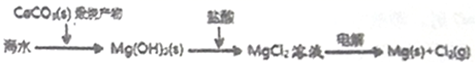
①钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用;②砹(At) 是第ⅦA族,其氢化物的稳定性大于HCl;③Na2FeO4可做水的消毒剂和净化剂;④陶瓷、玻璃、水晶、玛瑙、水泥、光导纤维的主要成分都是硅酸盐;⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应;⑥第三周期金属元素的最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱;⑦海水提镁的主要步骤为:
A.①③④⑦ B.①③⑥ C.③④⑤⑦ D.②④⑧
答案
B
【解析】
分析:①致密的氧化物能保护里面的金属;②元素的非金属性越强,气态氢化物的稳定性越强;③Na2FeO4中铁为+6价;④玻璃、水泥属于硅酸盐产品,水晶、石英、玛瑙等主要成分都是SiO2;⑤根据元素周期表中同主族元素性质的变化规律来分析;⑥根据元素周期表中同周期元素性质的变化规律来比较金属性,金属性越强,则最高价氧化物对应水化物的碱性越强;⑦工业上是电解熔融的氯化镁生产镁;
详解:①四氧化三铁是致密的能保护内部的钢铁不被腐蚀,故①正确;
②第VIIA族Cl元素的非金属性大于砹的非金属性,则砹的氢化物的稳定性小于HCl,故②错误;
③Na2FeO4中铁为+6价,具有强氧化性,能杀菌消毒,被还原后生成Fe3+,后水解为氢氧化铁胶体能净水,故③正确;
④玻璃、水泥属于硅酸盐产品,水晶、石英、玛瑙等主要成分都是SiO2,故④错误;
⑤铊(Tl)与铝同主族,随原子序数的增大,金属性增强,则金属性Tl>Al,则Tl能与酸反应,但不与氢氧化钠溶液反应,故⑤错误;
⑥第三周期金属元素随原子序数的增大金属性减弱,金属性Na>Mg>Al,则金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱,故⑥正确;
⑦电解氯化镁溶液得不到Mg,工业上是电解熔融的氯化镁生产镁,故⑦错误;
故①③⑥正确,答案选B。
点睛:本题考查了物质的用途,涉及元素化合物知识,明确物质的性质是解本题关键,根据物质的性质分析解答即可,熟练掌握常见物质的性质。


 SiO2+H2O
SiO2+H2O