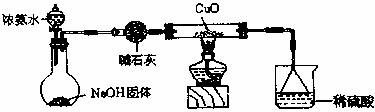
碱式氯化铜为绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向![]() 溶液中通入
溶液中通入![]() 和
和![]() ,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
(1)仪器X的名称是________,其主要作用有导气、________。
(2)实验室利用装置A制![]() ,发生反应的化学方程式为________。
,发生反应的化学方程式为________。
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象是________、________、________。
(4)若体系![]() 过高会导致碱式氯化铜的产量_______(填“偏高”、“偏低”或“无影响”)。
过高会导致碱式氯化铜的产量_______(填“偏高”、“偏低”或“无影响”)。
(5)反应结束后,将三颈瓶中的混合物过滤,从滤液中还可以获得的副产品是________(填化学式),经提纯得产品无水碱式氯化铜。
Ⅱ.无水碱式氯化铜组成的测定。称取产品![]() ,加硝酸溶解,并加水定容至200mL,得到待测液。
,加硝酸溶解,并加水定容至200mL,得到待测液。
(6)铜的测定:取20.00mL测液,经测定,![]() 浓为
浓为![]() 。则称取的样品中
。则称取的样品中![]() ________mol。
________mol。
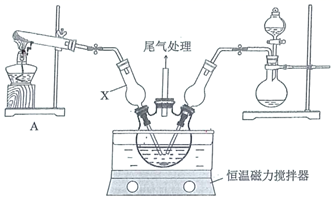
(7)采用沉淀滴定法测定氯:用![]() 标准溶液滴定过量的
标准溶液滴定过量的![]() ,实验如图:
,实验如图:

①滴定时,应选用下列哪种物质作为指示剂________(填标号)。
A.![]() B.
B.![]() C.
C.![]()
②重复实验操作三次,消耗![]() 溶液的体积平均为10.00mL。则称取的样品中
溶液的体积平均为10.00mL。则称取的样品中![]() ______mol。
______mol。
(8)根据上述实验结果可推知无水碱式氯化铜的化学式为________。
答案
球形干燥管 防倒吸 ![]() 溶液中有大量墨绿色固体产生 三颈烧瓶中有白烟 干燥管中有液体上升后下降的现象 偏低
溶液中有大量墨绿色固体产生 三颈烧瓶中有白烟 干燥管中有液体上升后下降的现象 偏低 ![]() 0.04000或0.04 B 0.02000或0.02
0.04000或0.04 B 0.02000或0.02 ![]()
【分析】
(1)根据仪器的形状用途回答;
(2)实验室制取氨气是利用氯化铵和氢氧化钙加热的条件下反应,生成氯化钙,氨气和水,写出化学方程式;
(3)反应过程中,在三颈烧瓶内生成碱式氯化铜,氯化氢进入,从气体的压强变化分析;
(4)从碱式氯化铜溶于氨水分析产量的变化;
(5)氨气与氯化氢会反应生成氯化铵作为副产物;
(6)根据稀释前后离子的物质的量不变进行计算;
(7) ①用![]() 标准溶液滴定过量的
标准溶液滴定过量的![]() ,根据滴定终点,判断所加的指示剂;
,根据滴定终点,判断所加的指示剂;
②利用10.00mL0.1mol/L的![]() 溶液计算出剩余的硝酸银的物质的量,利用总的硝酸银的物质的量减去剩余的硝酸银的物质的量,计算出与氯离子反应的硝酸银的物质的量,从而算出氯离子的物质的量,换算成样品中的氯离子的物质的量;
溶液计算出剩余的硝酸银的物质的量,利用总的硝酸银的物质的量减去剩余的硝酸银的物质的量,计算出与氯离子反应的硝酸银的物质的量,从而算出氯离子的物质的量,换算成样品中的氯离子的物质的量;
(8)根据铜离子,铝离子的物质的量,计算出样品的物质的量,根据质量和物质的量关系,计算出相对分子质量,减去铜和氯的相对原子质量,可以得到氢氧根离子的数目;
【详解】
(1)仪器X的名称是球形干燥管,其主要作用有导气、防止倒吸;
(2)实验室制取氨气的化学方程式为![]() ;
;
(3)在三颈烧瓶内,氯化铜,氨气和氯化氢气体反应制取碱式氯化铜,碱式氯化铜为绿色或墨绿色结晶性粉末,难溶于水,故实验现象为:①溶液中有大量墨绿色固体产生;由于通入的氯化氢气体和氨气相遇产生氯化铵,故实验现象②三颈烧瓶中有白烟生成;干燥管中充满了氨气和氯化氢气体,反应后气体的压强迅速减小,故实验现象③干燥管中有液体上升后下降的现象;
(4)若![]() 过高,会导致氨水浓度增大,会使碱式氯化铜有损耗,故导致碱式氯化铜的产量偏低;
过高,会导致氨水浓度增大,会使碱式氯化铜有损耗,故导致碱式氯化铜的产量偏低;
(5)该反应为氯化铜,氨气和氯化氢反应,氨气会和氯化氢反应生成氯化铵,作为副产物;
(6) 20.00mL待测液,![]() 浓为
浓为![]() ,则铜离子的物质的量为0.2mol/L×0.02L=0.004mol,由于称取的样品中是20ml溶液的10倍,所得铜离子的物质的量也是20mL溶液的10倍,样品中所含铜离子的物质的量为0.004mol×10=0.04000mol或0.04mol;
,则铜离子的物质的量为0.2mol/L×0.02L=0.004mol,由于称取的样品中是20ml溶液的10倍,所得铜离子的物质的量也是20mL溶液的10倍,样品中所含铜离子的物质的量为0.004mol×10=0.04000mol或0.04mol;
(7)①用![]() 标准溶液滴定过量的
标准溶液滴定过量的![]() ,到达滴定终点,用三价铁离子检验硫氰根离子,可以使用硝酸铁,不能使用氯化铁,由于氯化铁会和硝酸银反应生成氯化银沉淀,影响滴定终点的判断;
,到达滴定终点,用三价铁离子检验硫氰根离子,可以使用硝酸铁,不能使用氯化铁,由于氯化铁会和硝酸银反应生成氯化银沉淀,影响滴定终点的判断;
②10.00mL0.1mol/L的![]() 的物质的量等于0.1mol/L×0.01L=0.001mol,由
的物质的量等于0.1mol/L×0.01L=0.001mol,由![]() ~
~![]() 可知,未反应的硝酸银的物质的量等于0.001mol,共加入30mL0.1mol/L的的硝酸银,则与氯离子反应的硝酸银的物质的量等于0.03L×0.1mol/L-0.001mol=0.002mol,Cl-~Ag+,n(Cl-)=0.002mol,样品配成的是200mL溶液,滴定只取了20mL,样品中的氯离子是0.002mol×10=0.02mol;
可知,未反应的硝酸银的物质的量等于0.001mol,共加入30mL0.1mol/L的的硝酸银,则与氯离子反应的硝酸银的物质的量等于0.03L×0.1mol/L-0.001mol=0.002mol,Cl-~Ag+,n(Cl-)=0.002mol,样品配成的是200mL溶液,滴定只取了20mL,样品中的氯离子是0.002mol×10=0.02mol;
(8)测定无水碱式氯化铜组成时,称取产品![]() ,已知铜离子的物质的量为0.04mol,氯离子的物质的量为0.02mol,假设无水碱式氯化铜的化学式为
,已知铜离子的物质的量为0.04mol,氯离子的物质的量为0.02mol,假设无水碱式氯化铜的化学式为![]() ,可知无水碱式氯化铜的物质的量为0.02mol,摩尔质量为
,可知无水碱式氯化铜的物质的量为0.02mol,摩尔质量为![]() =214.5g/mol,64×2 g/mol +17x g/mol +35.5 g/mol =214.5 g/mol,解得x=3,故无水碱式氯化铜的化学式为
=214.5g/mol,64×2 g/mol +17x g/mol +35.5 g/mol =214.5 g/mol,解得x=3,故无水碱式氯化铜的化学式为![]() 。
。

 ,结构式为
,结构式为 ,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:
,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:






 ,氨的水溶液叫做氨水。在氨水中所含的微粒有:
,氨的水溶液叫做氨水。在氨水中所含的微粒有:
 氨水具有碱的通性,如能使无色酚酞溶液变红。
氨水具有碱的通性,如能使无色酚酞溶液变红。 

 (工业制HNO3的基础反应)
(工业制HNO3的基础反应) (Cl2过量)
(Cl2过量) (NH3过量,可用于检验Cl2瓶是否漏气)
(NH3过量,可用于检验Cl2瓶是否漏气)  (实验室制N2)
(实验室制N2)
 (治理氮氧化物污染)
(治理氮氧化物污染) 

 的比较:
的比较:


 固体混合反应,加热时反应速率显著增大。因为
固体混合反应,加热时反应速率显著增大。因为 在加热时可能发生爆炸性的分解反应:
在加热时可能发生爆炸性的分解反应:
 ,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成
,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成 ,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用
,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用 。
。  和生石灰(CaO)或烧碱:
和生石灰(CaO)或烧碱: 

 平衡右移,放出
平衡右移,放出 ,且NaOH、CaO溶于水均放热,可降低
,且NaOH、CaO溶于水均放热,可降低 ,在水中的溶解度。
,在水中的溶解度。  溶于水或使尿素在碱性条件下水解。
溶于水或使尿素在碱性条件下水解。 
 、无水
、无水 等作干燥剂,因为它们均能与NH3发生反应。
等作干燥剂,因为它们均能与NH3发生反应。