常温下,向1mol/LNH4Cl溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。实验观察到b点开始溶液中有白色沉淀生成,已知![]() 。下列说法错误的是
。下列说法错误的是
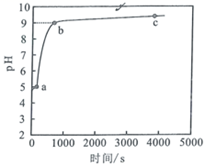
A.常温下,NH4Cl的水解平衡常数数量级为10−10
B.体系中,水的电离程度大小关系为![]()
C.![]() 点时,溶液中c(Mg2+)=0.18mol/L
点时,溶液中c(Mg2+)=0.18mol/L
D.a点溶液中,c(NH4+)+c(H+)<c(Cl−)+c(OH−)
答案
B
【详解】
A.常温下,NH4Cl的水解平衡常数数量级为![]() ≈10−10,A正确;
≈10−10,A正确;
B.a点时,NH4+水解,水的电离程度增大;b点时,pH=9,则由NH3∙H2O电离产生;c点时,pH>9,由NH3∙H2O电离产生,所以b、c两点水的电离受到抑制,且c点水的电离受到抑制的程度比b点大,所以水的电离程度大小关系为a>b>c,B错误;
C.![]() 点时,pH=9,c(OH-)=10-5mol/L,溶液中c(Mg2+)=
点时,pH=9,c(OH-)=10-5mol/L,溶液中c(Mg2+)=![]() =0.18mol/L,C正确;
=0.18mol/L,C正确;
D.a点溶液中,依据电荷守恒可得2c(Mg2+)+c(NH4+)+c(H+)=c(Cl−)+c(OH−),所以c(NH4+)+c(H+)<c(Cl−)+c(OH−),D正确;
故选B。
【点睛】
分析溶液中微粒浓度关系时,首先应判断建立此关系的前提是什么?是电荷守恒、物料守恒,还是质子守恒?然后才能利用电离及水解反应的主次进行判断。

 ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。 

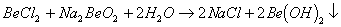 能完全进行,则下列推断中,正确的是
能完全进行,则下列推断中,正确的是 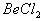 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO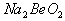 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO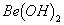 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液